CAR-T细胞回输前缩小和控制MATV可改善LBCL患者的生存结局
与标准二线及三线免疫化疗相比,CD19 CAR-T细胞治疗可显著改善复发或难治性(R/R)大B细胞淋巴瘤(LBCL)患者的预后-2。然而,由于CAR-T细胞制备工艺的复杂性,实际上部分R/R LBCL患者从确定符合CAR-T治疗适应症到CAR-T细胞回输可能需要等待4-6周。因此,许多患者在单采至回输期间可能需要接受桥接治疗,以控制疾病进展,减轻淋巴瘤相关症状和/或缩小肿瘤体积。
为精确描述桥接治疗的应答特征,需明确不同桥接治疗方案导致的肿瘤体积缩小与CAR-T细胞治疗结局之间的关系。代谢活性肿瘤体积(MATV)是衡量疾病负担的重要指标,指全身代谢活跃的肿瘤总体积。使用18F-氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(18F-FDG PET/CT)测量MATV可对肿瘤体积进行量化。
目前不同桥接治疗方案所引发的MATV的动态变化数据依然不足-3。本研究旨在探讨MATV和MATV动力学[基线至清淋(LD)前]与CAR-T细胞治疗结局及毒性之间的关系,包括不同桥接策略对R/R LBCL患者的MATV和CAR-T细胞治疗结局影响[8]。
Keijzer K, et al. Reducing and controlling metabolic active tumor volume prior to CAR T-cell infusion can improve survival outcomes in patients with large B-cell lymphoma. Blood Cancer J. 2024 Mar 7;14(1):41.
-
基线低MATV的患者具有最佳TTP和OS,严重CRS(≥2级)的发生率更低。
-
桥接期间有效缩小或控制MATV改善了基线高MATV患者的生存结局。
研究方法
该研究纳入74例在2017年10月至2022年9月期间接受Axicabtagene ciloleucel(Axi-cel)治疗的LBCL患者,包括弥漫大B细胞淋巴瘤(DLBCL)、转化性滤泡性淋巴瘤(tFL)和高级别B细胞淋巴瘤(HGBCL),高级别B细胞淋巴瘤非特指型(HGBCL NOS)或双打击/三打击高级别B细胞淋巴瘤(HGBCL DH/TH)。在基线(单采前)和LD前(桥接治疗后,开始LD前)进行18F-FDG-PET扫描[8]以测量R/R LBCL患者的MATV。
桥接治疗定义为在单采后至清淋前期间对LBCL患者进行的任何治疗(若患者在单采前接受治疗,只有在18F-FDG-PET成像后进行治疗才被认定为桥接治疗)。基于患者个体的特点(肿瘤体积、肿瘤位置、疾病进展和对早期治疗的应答)选择桥接治疗方案,桥接策略包括局灶放疗、系统治疗或放疗联合系统治疗。
研究的主要终点为至疾病进展时间(TTP)和总生存期(OS),前者定义为从单采到疾病进展的时间,后者定义为从单采到因任何原因死亡的时间。由于相关事件均发生在2年内,因此生存期以2年为截断点。次要终点为≥2级细胞因子释放综合症(CRS)和≥2级免疫效应细胞相关神经毒性综合征(ICANS)。
研究结果
基线和清淋化疗前的MATV特征
整个队列的基线中位MATV为180cc[IQR 64-426](n=74)。在LD前,中位MATV增加到241cc[IQR 75-525],但与基线相比无显著差异(P=0.795;n=68)。与基线相比,LD前未接受桥接治疗患者的MATV增加(P=0.008),接受放疗桥接 (P = 0.193)、系统治疗桥接 (P = 0.193)患者的MATV下降不显著,观察到接受联合治疗桥接患者(P=0.577)的MATV无显著性增加(详见图1a)。
观察每个患者的MATV变化情况,发现接受放疗桥接的大部分患者的MATV下降。当患者出现治疗目标区域外围进展时,观察到MATV的增加。系统桥接治疗和联合桥接治疗患者显示出更混合的应答,而未接受桥接治疗的患者显示出MATV总体增加(即进展)(详见图1b)。
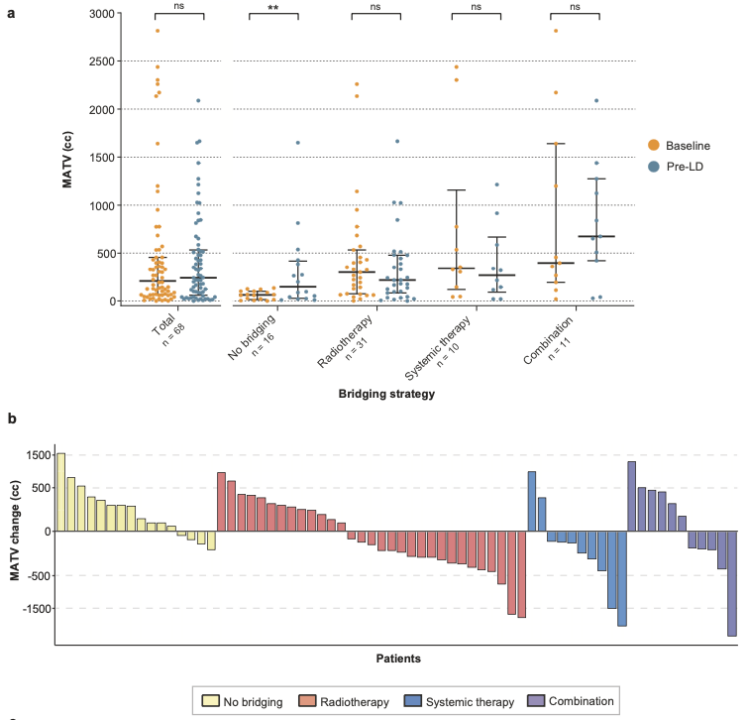
图1 关于基线和LD前接受桥接治疗的MATV情况[8]
MATV与至进展时间(TTP)和总生存期(OS)之间的关联
基线和LD前2年TTP的最佳MATV分界点 (cut-off point) 分别为190 cc 和 480 cc。基线时,低MATV vs 高MATV患者的2年TTP率分别为86.9% vs 51.7%(P<0.001;图2a);低MATV vs 高MATV患者的2年OS率分别为85.0% vs 38.5%(P<0.0001;图2d)。
桥接治疗后LD前,与桥接治疗过程中保持高MATV的患者(31.4%的生存率)相比,基线时高MATV但接受桥接治疗后成功降至低MATV患者(67.1%的生存率)的TTP有显著改善(P=0.041;图2c)。OS也有类似趋势(P=0.015;图2f)。
基线时低MATV且在LD前仍保持低MATV患者的2年TTP率(92.2%)和2年OS率(90.8%)最佳(图2b)。而基线时低MATV但在LD前进展为高MATV患者的2年TTP率(75.0%;图2b)和2年OS率(50.0%;图2e)较差,但由于该组中只有4例患者,此差异不显著(P>0.1)[8]。
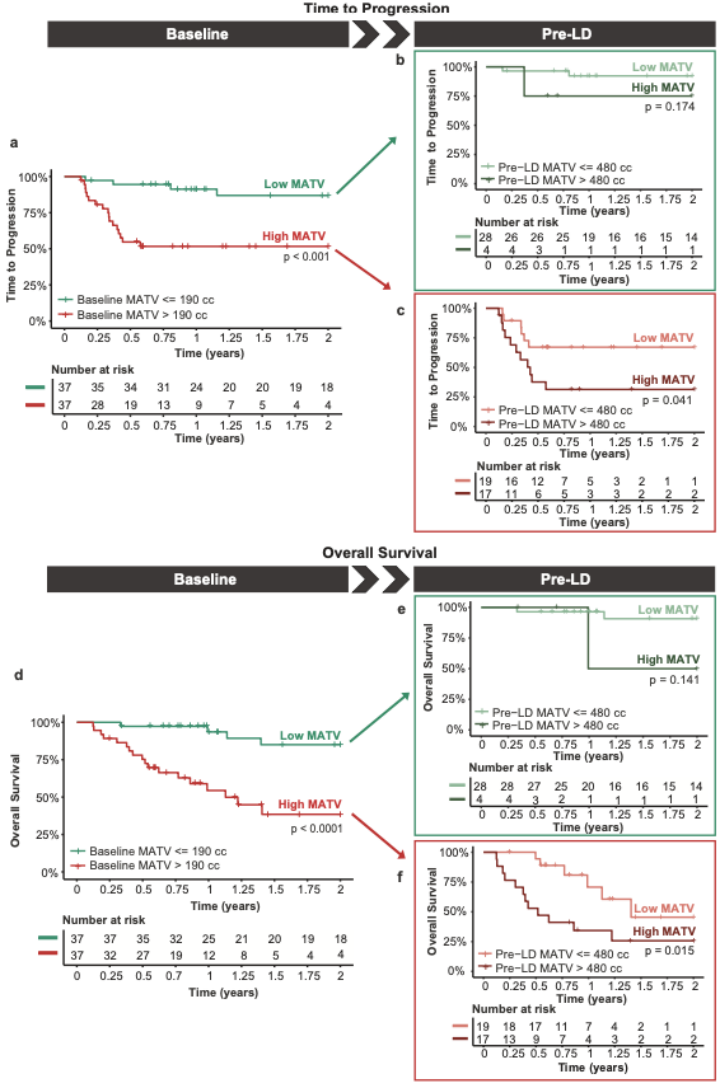
图2. 基线和LD前低或高MATV患者的生存结局[8]
MATV与不良事件的关系
CRS≥2级患者的基线中位MATV(398 cc[IQR 266-684])显著高于CRS 为0-1级的患者(基线中位MATV:125 cc[IQR 60-317])。
与ICANS为0-1级的患者(基线中位MATV:222 cc [IQR 66-406])相比,ICANS≥2级患者的中位基线中位MATV(194 cc[IQR 67-495];P = 0.827)更低,但无统计学差异;与ICANS为0-1级的患者(LD前中位MATV:217 cc [IQR 43–510])相比,ICANS≥2级患者的LD前中位MATV(332 cc [IQR 120-830];P=0.374)更高,但也无统计学差异[8]。
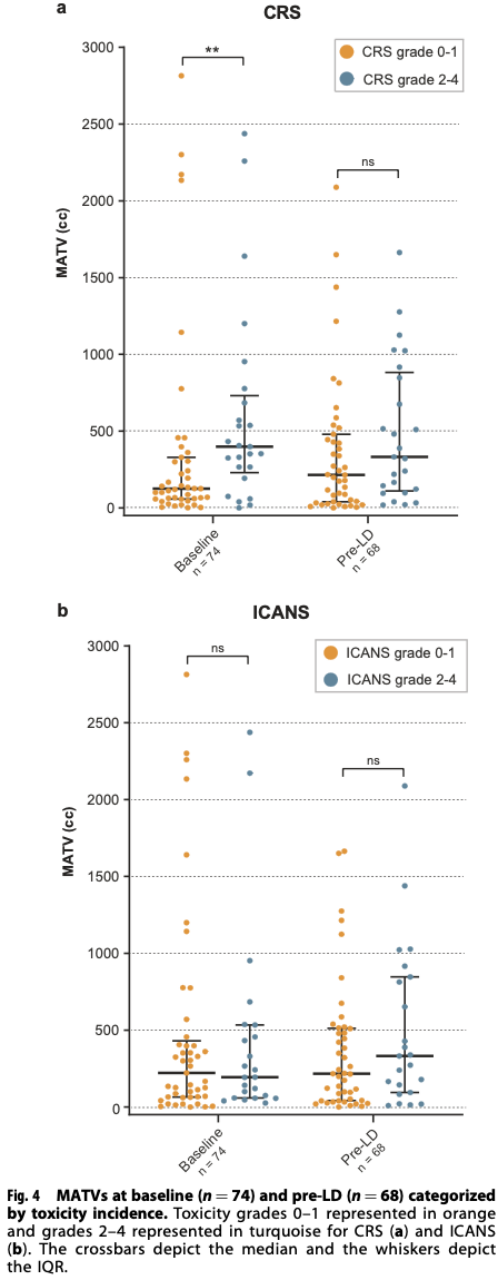
图3 发生0-1级或2-4级CRS/ICANS患者的基线(n = 74)和LD前(n = 68)MATV[8]
研究结论
总而言之,基线低MATV的患者具有最佳TTP和OS,严重CRS(≥2级)的发生率更低。在桥接期间有效缩小或控制MATV改善了基线高MATV患者的生存结局,为CAR-T回输前使用更积极的桥接治疗方案提供了理论基础。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2024.3-15 valid until 2026.3
供稿与审核:临床开发与医学部
推荐阅读
-
ZUMA-7研究中二线接受Axi-cel或SOC治疗后的后续抗淋巴瘤治疗的结局
-
-
肿瘤微环境分析阐释二线Axi-cel与SOC治疗LBCL的疗效差异
-
【2023 ASH】EBMT/Gocart真实世界数据:CD19 CAR-T细胞可有效治疗PCNSL和SCNSL患者
-
【2023 ASH】CIBMTR真实世界证据:LBCL患者在CR状态下接受CAR-T巩固治疗仍可获益
-
【2023 ASH】真实世界证据:CAR-T治疗R/R LBCL获益不受高龄影响
-
【2023 ASH】CAR-T治疗显著改善双打击/三打击淋巴瘤患者生存:早用更获益
-
【2023 ASH】CIBMTR真实世界证据:桥接治疗对Axi-cel治疗R/R LBCL的影响
-
单细胞RNA分析表明第三代CAR-T细胞的内在功能特征与淋巴瘤疗效相关
-
【2023 ASH】ZUMA-1研究6年随访生存数据:Axi-cel点亮难治性LBCL治愈之光
-
【2023 ASH】Axi-cel治疗LBCL:二线 vs 三线,早用更获益
-
【2023 ASH】CAR-T二线治疗R/R LBCL的真实世界证据
-
【2023 ASH】ZUMA-12的3年随访分析展示Axi-cel在一线高危LBCL患者治疗中的风采
-
【2023 ASH】真实世界中Axi-cel治疗LBCL患者的5年随访结局彰显治愈希望
-
【2023 ASH】Brexu-cel治疗R/R B-ALL成人患者的真实世界证据
-
【2023 ASH】CAR-T之声:一文速览Brexul-cel相关研究的最新进展
-
【ASH 2023】CAR-T细胞治疗重塑DLBCL患者的生存趋势
-
【2023 ASH】CAR-T之声:一文速览Axi-cel相关研究的最新进展
-
CAR-T细胞治疗合并肾功能减退的LBCL患者的真实世界结局
-
临床前研究提示来那度胺可改善第三代CD19 CAR-T细胞对DLBCL的疗效
-
【2023 ESMO】治疗3L+ R/R LBCL,Axi-cel vs Glofit,孰优孰劣?
-
Yescarta®全球上市6周年,为淋巴瘤患者点亮治愈的希望之光
-
奕凯达治疗R/R NHL继中国真实世界研究中期分析数据后再添亚裔人群证据,赵维莅等教授评论文章NEJM新发布!
-
CAR-T细胞治疗R/R LBCL的不良预后因素:欧洲 vs 美国患者
-
CAR-T治疗B-NHL的安全性和有效性不受合并自身免疫性风湿性疾病的影响
-
ctDNA可提高Axi-cel治疗R/R LBCL后PET的特异性
-
有效的桥接疗法可改善CAR-T治疗R/R LBCL患者的临床结局

