EHA新浪潮丨CAR-T,老年患者的福音

因为身体虚弱且存在潜在的合并症,老年患者的预后通常很差。由于毒性增加,许多老年患者不适合积极挽救治疗,包括大剂量化疗或自体干细胞移植。CAR-T细胞疗法已成为R/R LBCL的潜在治愈性疗法。在一般患者人群中CAR-T疗法获益明确,近年来在老年患者中的应用数据也不断更新。结合2024年EHA大会报道和近年来的其他相关研究,本期小编与您分享CAR-T疗法在老年B细胞淋巴瘤患者的应用。
一
2024 EHA:CAR-T可用于≥80岁B细胞淋巴瘤患者
2024年EHA大会上,Chavez DJ等报道了一项涉及美国16个学术中心的观察性多中心研究,评估了CAR-T疗法在≥80岁B细胞淋巴瘤患者中的疗效和安全性特征。基线特征见表1。Axi-cel是最常用的CAR-T治疗产品(46.6%)。大多数患者(87.5%)在住院环境中接受了CAR-T相关治疗,中位住院持续时间为14天。
表1. 基线特征

84例可评估患者中,60例(71.4%)的最佳缓解为CR,至CR的中位时间为38天。DLBCL/转化的FL患者的12个月PFS率和OS率分别为46.3%和61.2%。对于套细胞淋巴瘤,12个月PFS率和OS率分别为40%和38.9%。所有疾病的1个月和3个月非复发死亡率分别为1.2%和3.9%(见图1)。
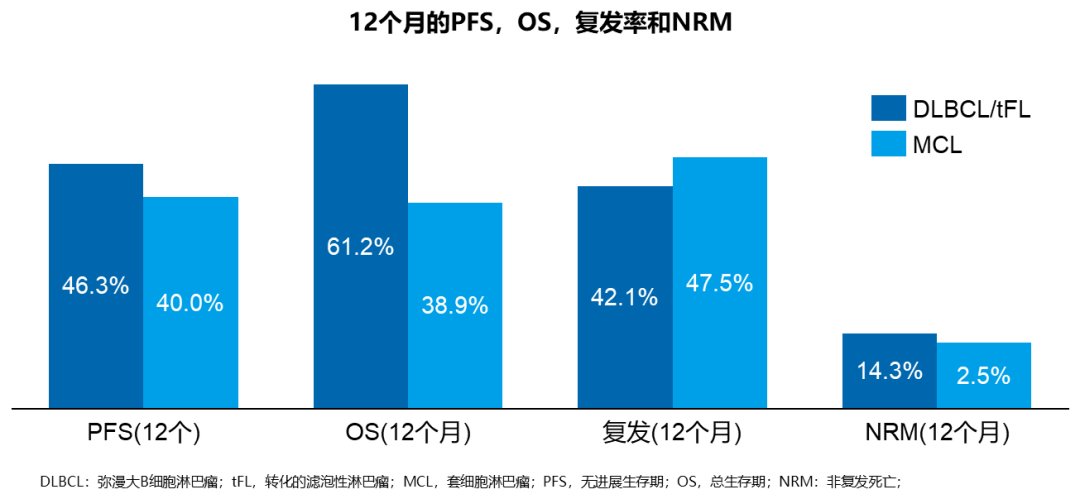
图1. ≥80岁B细胞淋巴瘤患者接受CAR-T治疗的12个月PFS、OS、复发率和NRM
21例(23.9%)患者在CAR-T输注后的前100天内需要再次入院。68例(77.3%)患者在中位3天时发生任何级别CRS,其中仅5例(7.4%)发生3-4级CRS。51例(58%)在中位6天时发生ICANS。ICANS症状的中位持续时间为6天(见表2)1。
表2. ≥80岁B细胞淋巴瘤患者接受CAR-T治疗的安全性

二
2024 EHA:大样本真实世界数据证实CAR-T可用于≥75岁R/R LBCL患者
2024年EHA大会上,Guffroy B等报道了一项真实世界研究,纳入2018年4月至2023年9月期间法国DESCAR-T登记的1524例≥2线治疗的连续R/R LBCL患者,患者接受了CAR-T输注(Axi-cel [69.8%]和tisa-cel [30.1%])。其中,125例患者≥75岁和1399例患者<75岁。两个年龄组在性别、LBCL亚型、既往治疗线数、体能状态、年龄校正的国际预后指数、接受桥接治疗的患者比例、桥接治疗应答和输注时LDH方面无显著差异。
在1457例可评估缓解的患者中,≥75岁组的最佳ORR/CRR为74.8%/62.6%,而<75岁组为78.0%/60.8%(P值分别为0.425和0.699)。≥75岁组和<75岁组的估计中位OS分别为18.3个月和24个月(P=0.12)(见图2),中位PFS分别为8.2个月和6.1个月(P=0.73)。
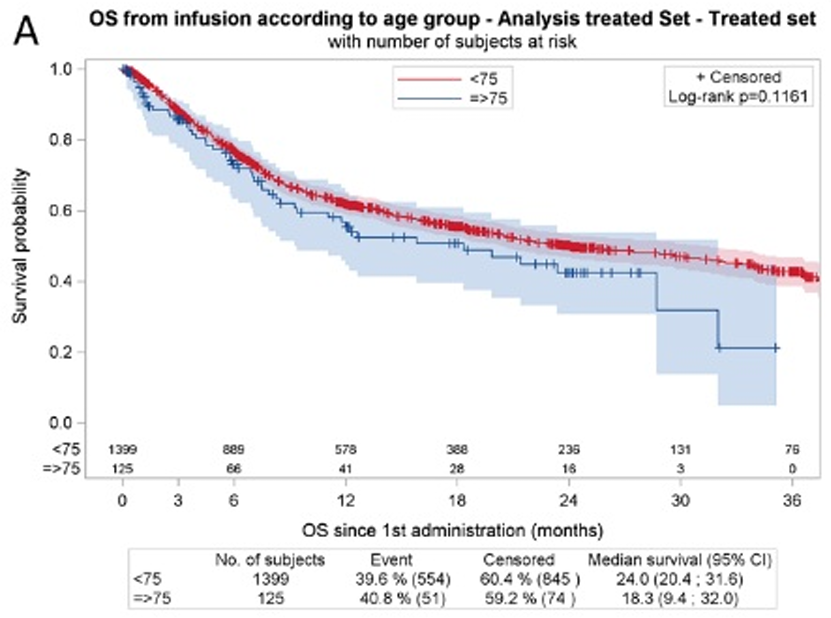
图2. ≥75岁组和<75岁组的生存曲线
≥75岁患者与<75岁患者的≥ 3级CRS(7.3% vs. 7.4%,p=0.97)和ICANS(9.8% vs. 12.4%,P=0.39)发生率无显著差异。这项真实世界的研究表明,CAR-T疗法在≥75岁患者群体中是可行的2。
此外,近期发表的多项回顾性研究也表明CAR-T疗法在≥70岁R/R DLBCL患者或≥75岁恶性血液病(B细胞NHL或MM)患者中是可行和有效的(见表3)。老龄(≥70岁或≥75岁)对CAR-T疗法的生存获益和安全性无显著影响(见表1)3,4。上述结果表明,CAR-T治疗在老年(甚至≥80岁高龄)B细胞淋巴瘤患者中是可行的,总体安全性可控。
表3. 其他真实世界研究中CAR-T治疗在老年患者中的应用

三
ZUMA-1和ZUMA-7研究亚组分析:Axi-cel在≥65岁人群表现出临床获益优于总体人群的趋势
ZUMA-1研究是一项单臂、多中心、开放标签I/II期临床研究,在R/R LBCL患者中评估Axi-cel用于≥3线治疗的安全性和有效性。中位随访27.1个月(随访2年)时,ORR为83%,CR率为58%。中位PFS为5.9个月,2年OS率为50.5%5。中位随访63.1个月(随访5年)时,ORR为83%,CR率为58%,中位OS为25.8个月,估计5年OS率为42.6%6。
Neelapu SS等对ZUMA-1研究进行了事后分析,结果表明≥65岁组 vs. <65岁组的ORR分别为92% vs. 81%,CR率分别为75% vs. 53%。中位PFS分别为13.2个月 vs 5.6个月(见图3)。2年OS率分别为54% vs. 49%7。
可见,ZUMA-1研究中老龄(≥65岁)对临床获益无明显影响,甚至表现出较总体人群更高ORR、CR率、中位PFS的趋势。

图3. ZUMA-1研究事后分析中年龄≥65岁人群 vs <65岁人群的PFS
ZUMA-7是一项随机、开放标签、全球、多中心、III 期研究,旨在比较Axi-cel vs. 二线标准治疗(SOC)的疗效与安全性。在中位随访24.9个月时,Axi-cel组 vs. SOC组的中位EFS为8.3个月 vs. 2.0个月,(HR=0.40; P<0.001)。Axi-cel组 vs. SOC组的ORR分别为83% vs. 50%,CR率分别为65% vs. 43%。Axi-cel组 vs. SOC组的2年估计OS率为61% vs. 52%8。中位随访47.2个月时,4年OS率分别为54.6%和46.0%9。亚组分析显示,≥65 岁 vs.<65 岁患者的EFS有更优的趋势(HR别为0.28、0.49)8。
Westin JR等报道了ZUMA-7研究中≥65岁R/R LBCL患者的预设亚组分析结果。结果显示,51例和58例年龄≥65岁的患者分别随机分配至Axi-cel和SOC组。Axi-cel组的中位EFS显著优于SOC组(21.5个月vs. 2.5个月; HR,0.276; P < 0.0001)。Axi-cel组的ORR显著高于SOC组(88% vs. 52%; P < 0.0001;完全缓解率:75% vs. 33%)(见图4)。生活质量分析也显示Axi-cel组更优(P < 0.05)10。
ZUMA-7研究的亚组分析同样提示,老龄(≥65岁)对临床获益无明显影响,甚至表现出较总体人群更高ORR、CR率和EFS的趋势。ZUMA-1和ZUMA-7研究的亚组分析均表明,CAR-T疗法为老年R/R LBCL患者带来了更好的治疗选择。
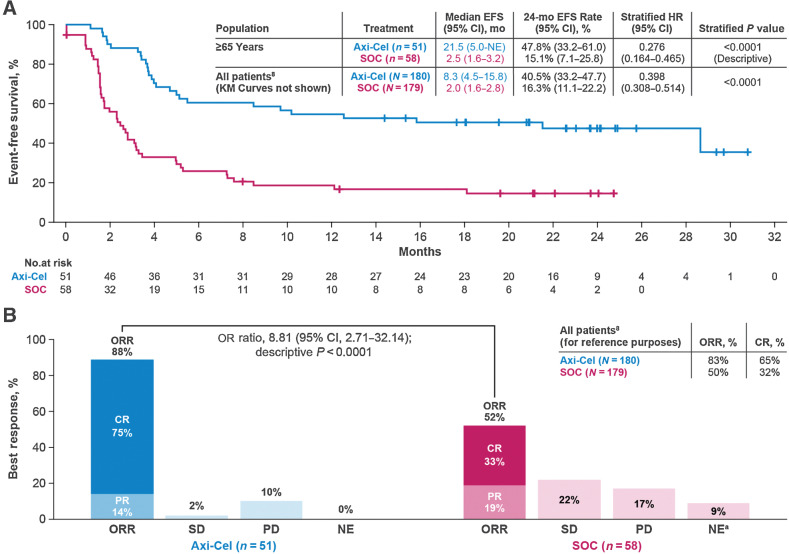
图4. ZUMA-7研究中年龄≥65岁人群和总体人群CAR-T治疗的EFS和缓解情况
四
探索老年患者CAR-T治疗的合适评估工具
鉴于CGA在识别老年病脆弱性(如多合并症、功能和认知障碍)以及多药指导治疗强度方面的有效性;为了管理与治疗相关的毒性,美国临床肿瘤学会(ASCO)指南建议所有老年癌症患者在癌症治疗前和治疗期间接受CGA评估,以避免过度治疗和治疗不足6。
Zhang H等招募了31例年龄超过65岁的R/R DLBCL患者接受 CAR-T治疗。根据综合老年评估(CGA)将患者分为健康(fit)、不健康(unfit)或虚弱(frail)组(见表4)。
表4. 根据CGA结果的分组标准

Fit组的ORR和CR高于unfit/frail组,但两组间PR无差异。Fit组的中位PFS高于unfit/frail组(11.4个月vs. 7.0个月; P<0.037)。Fit组(未达到)的中位OS优于unfit/frail组(11.0个月)(P <0.002)(见图5)。Unfit/frail组比fit组更有可能发生AE。Fit组CAR-T细胞的峰值比例显著高于unfit/frail组(见图6)。该结果提示CGA可用于有效预测治疗反应、不良事件和长期生存11。尽管该研究表明fit患者(<80岁、ADL和IADL好、合并症少)CAR-T治疗获益更多,AE风险更低,但并不意味着≥80岁患者是CAR-T治疗的禁忌症,结合前文所述CAR-T治疗在≥80岁人群中的可行性和有效性,临床上应该综合考虑患者年龄、日常生活能力、合并症等情况,以评估老年患者CAR-T治疗的风险与获益。
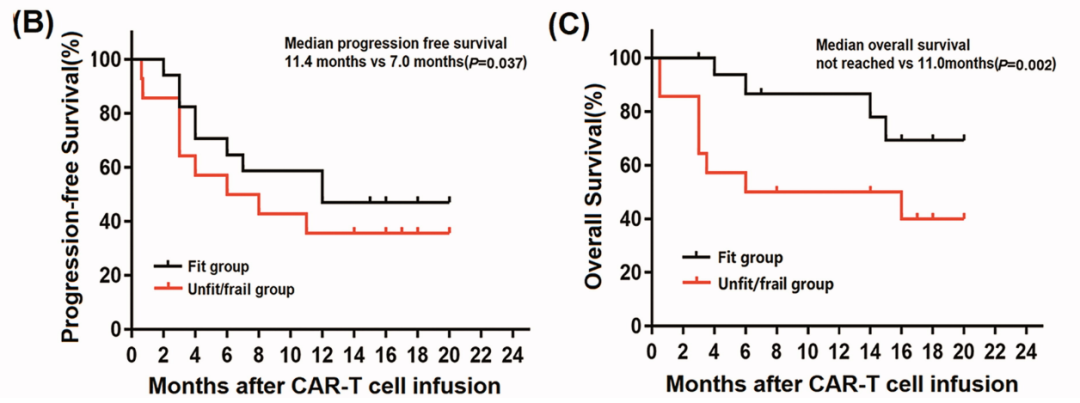
图5. fit组抗CD 19 CAR T细胞的峰值比例显著高于unfit/frail组
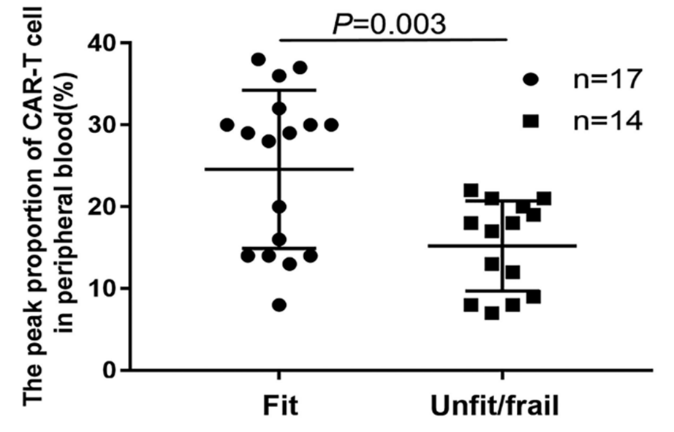
图6. Fit组抗CD 19 CAR T细胞的峰值比例显著高于unfit/frail组
Yates SJ等探讨了老年病学评估(CGA)指导的多学科诊所(GA-MDC)在选择和优化老年患者进行CAR-T治疗中的作用。根据CGA结果,为每例患者提供了关于CAR-T适用性的非约束性建议(“继续”或“拒绝”)。与评估为“拒绝”的患者相比,评估为“继续”的患者中位住院时间更短(17 vs 31天; p=0.05),ICU入院率更低(6% vs 50%; p=0.01),中位OS更优(16.6 vs 11.4个月,p=0.02)12。可见,CGA评估可以指导老年患者更好的接受CAR-T治疗。
五
总结
诸多研究均证实老年(甚至≥80岁高龄)患者进行CAR-T治疗是可行的,甚至表现出疗效更优的趋势,且安全性可控。CAR-T为老年患者带来了更好的治疗选择。但鉴于老年患者的个体情况复杂,临床上可考虑通过综合老年病学评估(CGA)筛选适合CAR-T治疗的老年患者。
参考文献

