ZUMA-7研究中二线接受Axi-cel或SOC治疗后的后续抗淋巴瘤治疗的结局
近30年来,大B细胞淋巴瘤(LBCL)的二线标准治疗(SOC)是大剂量化疗联合自体干细胞移植(HDT-ASCT)[1]。然而,不能接受HDT-ASCT患者的预后较差[2]。
抗CD19 CAR-T细胞疗法Axicabtagene Ciloleucel (Axi-cel) 在复发/难治性(R/R)LBCL的二线及三线治疗中均展现出显著的临床获益[1,3-8]。目前,Axicabtagene Ciloleucel (Axi-cel) 已获批的适应症包括:1. 治疗既往接受过≥2线系统性治疗的R/R LBCL成人患者;2. 治疗一线化学免疫治疗难治或一线化学免疫治疗后12个月内复发的LBCL成人患者[6,9-11]。然而,对于因缓解不足或疾病进展而需要额外治疗的LBCL患者,二线治疗后的最佳治疗管理仍未明晰[8,12]。本研究描述了ZUMA-7研究中二线治疗后R/R LBCL患者后续接受的抗淋巴瘤治疗结局。
Armin Ghobadi, et al. Outcomes of subsequent anti-lymphoma therapies after second-line axicabtagene ciloleucel or standard of care in ZUMA-7. Blood Adv. 2024 Feb 5:bloodadvances.2023011532.
-
对于二线接受SOC进展后再使用CAR-T细胞治疗,仍可带来获益。
-
对于接受CAR-T细胞治疗的患者而言,二线结局显著优于三线,早线使用更加获益。
研究方法
关于ZUMA-7研究的主要设计:该研究纳入年龄≥18岁、组织学确诊为LBCL、一线免疫化疗后进展的R/R LBCL患者,按1:1的比例随机分组接受Axi-cel 或 SOC治疗。主要终点是无事件生存期(EFS),关键次要终点为客观缓解率(ORR)、完全缓解(CR)率、总生存期(OS)、无进展生存期(PFS)和安全性等。
关于二线治疗后的后续抗淋巴瘤治疗:SOC组的三线治疗分为细胞免疫治疗和其他治疗(未接受细胞免疫治疗或在四线及以上接受细胞免疫治疗);Axi-cel组的三线治疗分为化疗、细胞免疫治疗或其他。Axi-cel组的三线细胞免疫治疗仅限于首次疾病评估时最初达到完全缓解(CR)或部分缓解(PR)但后来出现疾病进展的患者,在二线治疗进展后接受Axi-cel再治疗方案。需要明确的是,疾病未进展时,若在局部治疗或临时措施[包括清淋化疗、类固醇、放疗或仅利妥昔单抗(无其他化疗,包括含维泊妥珠单抗或利妥昔单抗的化疗)]之前进行细胞免疫治疗,则认定为三线治疗。若在化疗桥接治疗后接受CAR-T细胞治疗,则被认定为四线治疗[13]。

图1 Axi-cel组 vs SOC组的三线治疗分类
研究结果
后续三线治疗概述
关于ZUMA-7研究,在2018年1月25日至2019年10月4日期间,共359例患者随机分组至Axi-cel组(180例)和SOC组(179例)进行二线治疗。
在SOC组中,168/179例患者接受≥1剂二线治疗,最终62例获得了研究方案中规定的HDT-ASCT治疗,106例未接受HDT-ASCT治疗;71%(127/179)的患者接受了后续三线治疗(图2A),其中68例患者接受三线细胞免疫治疗,59例患者接受其它三线治疗。
在Axi-cel组中,170例患者接受了Axi-cel二线治疗,47%(84/180)的患者接受了后续三线治疗(图2B)[13]。随机分组至三线治疗的中位时间为4.4个月(0.2 - 22.3),60例患者接受三线化疗,8例患者接受三线Axi-cel细胞免疫治疗。
两组患者中,总计14例患者(SOC组8例,Axi-cel组6例)因疾病进展未接受三线治疗,其中13例为原发难治患者。最终,14例患者全部死亡,随机分组后的中位生存时间为2.1个月[13]。
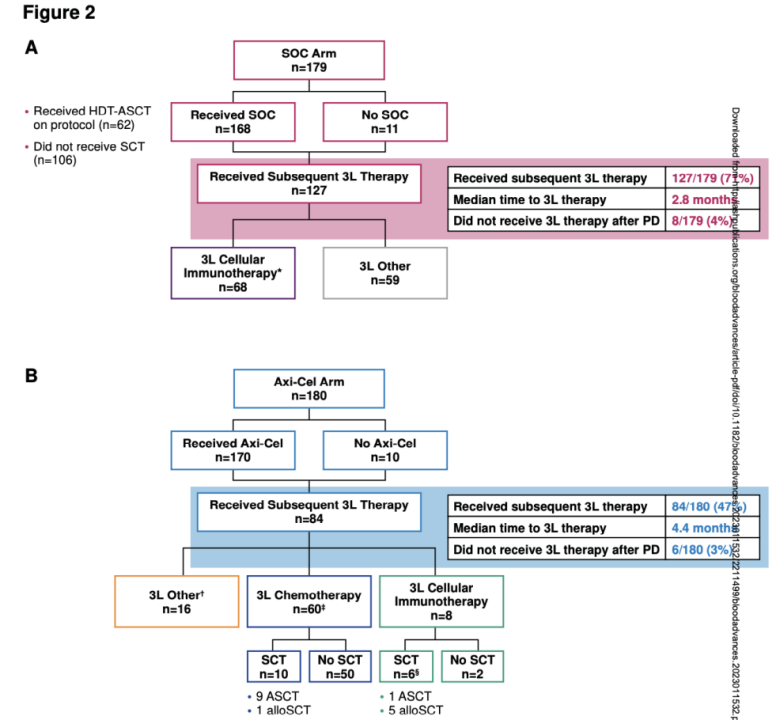
图2 Axi-cel组 vs SOC组后续治疗的患者分布
SOC组的三线治疗结局
开始三线治疗后,SOC组127例患者的PFS及OS的中位随访时间分别为16.6个月(范围:0 - 33.0)和20.0个月(范围:0.2 - 35.7)。68例三线接受细胞免疫治疗患者的中位PFS为6.3个月(95%CI:3.4 - 16.3),中位OS为16.3个月(95%CI:8.7 - NE)。59例三线接受其他治疗患者的中位PFS和中位OS分别为1.9个月(95%CI:1.1 - 2.7)和9.5个月(95%CI:6.6 - 15.4)(图3)。三线接受 vs 未接受细胞免疫治疗患者的12个月PFS率分别为41% vs 20%;12个月OS率分别为56% vs 41%(图3)。68例三线接受细胞免疫治疗患者的客观缓解率(ORR)为57%(95%CI:45 - 69),CR率为34%(95%CI:23 - 46)[13]。
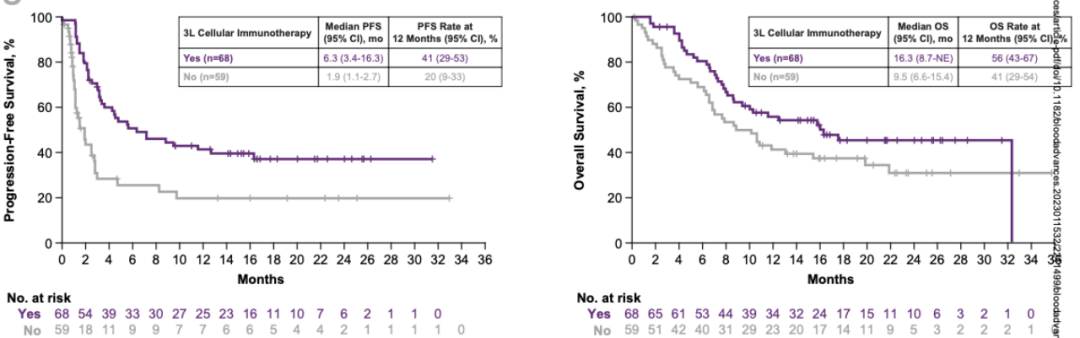
图3 三线治疗开始后,SOC组三线细胞免疫治疗的PFS和OS
Axi-cel组的三线治疗结局
Axi-cel组的84例患者开始三线治疗后的PFS及OS的中位随访时间分别为15.7个月(范围:0 - 27.4)和18.6个月(范围:0.4 - 32.3)。60例三线接受化疗患者的中位PFS为1.7个月(95%CI:1.4 - 2.0),中位OS为8.1个月(95%CI:5.8 - 11.5)(图4);ORR为25%(95%CI:15 - 38),CR率为13%(95%CI:6 - 25)。34/60例接受三线化疗且对Axi-cel二线治疗有初始应答患者的中位PFS为1.7个月(95%CI:1.4 - 2.4),中位OS为8.1个月(95%CI:6.8 - 11.9),ORR为32%,CR率为18%。26/60例接受三线化疗治疗但对Axi-cel二线治疗无应答患者的中位PFS为1.6个月(95%CI:1.1 - 2.0),中位OS为6.9个月(95%CI:3.3 - NE),ORR为15%,CR率为8%。8例三线接受细胞免疫治疗患者的中位PFS为3.5个月(95%CI:1.1 - NE),中位OS未到达(95%CI:8.7 - NE)。16例三线接受其他治疗患者的中位PFS为3.5个月(95%CI:0.8 - 5.9),中位OS为8.6个月(95%CI:5.5 - NE)(图4)[13]。
在60例三线接受化疗的患者中,50例未能进行SCT的患者的中位PFS为1.6个月(95%CI:1.2 -1.8),中位OS为7.2个月(95%CI:4.8 - 9.1),ORR为14%(95%CI:6 - 27),CR率为4%(95%CI:0.5 - 14)。10例后续进行了SCT治疗的患者中位PFS为11.5个月(95%CI:2.4 - NE),中位OS为17.5个月(95%CI:2.4 - NE),ORR为80%(95%CI:44 - 97),CR率为60%(95%CI:26 - 88)。开始三线化疗至SCT的中位时间为2.7个月[13]。
接受三线细胞免疫治疗的8例患者,从首次Axi-cel回输到首次评估疾病进展的中位时间为3.0个月(范围:2.6 - 17.1)。三线Axi-cel治疗的ORR和CR率分别为75%和50%。6/8例患者在任意线接受后续SCT治疗(1例HDT-ASCT,5例Allo-SCT)。SCT后,5/6例患者保持CR,接受SCT的全部6例患者至数据截止时仍然存活(开始三线治疗后的中位随访时间为24.4个月)[13]。
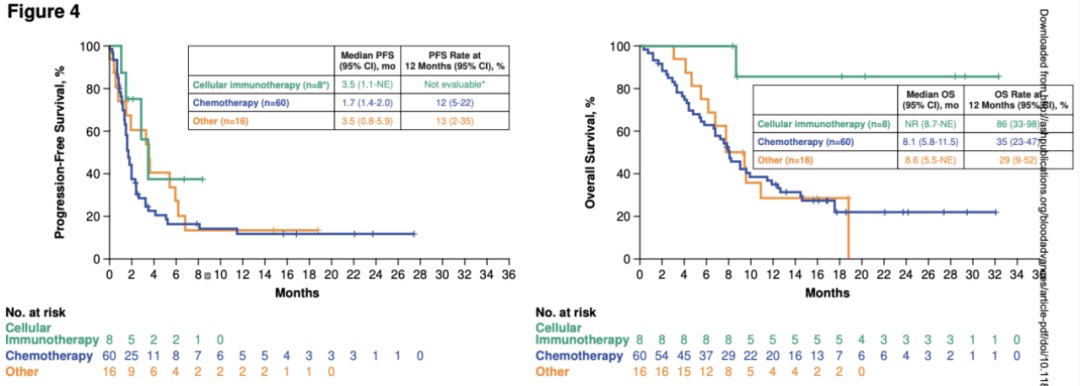
图4 三线治疗开始后,Axi-cel组三线细胞免疫治疗的PFS和OS
任意线接受细胞免疫治疗的结局
SOC组中,100例患者在任意线接受后续细胞免疫治疗,32例患者在≥4线接受细胞免疫治疗。接受任意线细胞免疫治疗患者的ORR为54%(95% CI:44 - 64),CR率为30%(95% CI:21 - 40)。与未接受细胞免疫治疗的患者相比,接受任意线细胞免疫治疗患者的生存结局更优,死亡风险更低(HR = 0.33;95%CI:0.16 - 0.68)[13]。
Axi-cel组中,接受任意线细胞免疫治疗患者的ORR为77%(95% CI:46 -95),CR率为46%(95% CI:19 - 75)。与接受其他治疗的患者相比,接受任意线细胞免疫治疗患者的生存结局更优,死亡风险更低(HR = 0.22;95%CI:0.07 - 0.66)。与之相反,在Axi-cel组中,与接受其他治疗相比,接受任意线化疗患者的死亡风险更高(HR = 1.50;95%CI:0.58 - 3.89)。在化疗或其他治疗后,鲜有患者(19/76例,不包括6例三线Axi-cel再治疗后接受SCT的患者)符合SCT。然而,对于接受SCT的患者(不包括三线Axi-cel再治疗后接受SCT的患者),与接受其他治疗相比,接受后续任意线SCT治疗患者的生存结局更优(HR = 0.39;95%CI:0.17 - 0.88)[13]。
研究结论
研究结果表明,更早线采用CAR-T细胞疗法可能有助于改善CAR-T治疗LBCL患者的临床结局,但仍需进一步研究。细胞免疫治疗可能是对二线Axi-cel治疗有初始应答后进展患者的可选方案。相比之下,后线化疗的结局较差;仅少数能进行SCT患者的结局有所改善。
尽管本研究所报告的患者数有限,尚未得出明确结论,但这些结果为R/R LBCL患者经过二线疗法失败后的后续治疗选择提供了初步证据,以指导后续的治疗选择,为二线治疗失败的R/R LBCL患者带来了更多的临床获益[13]。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2024.3-15 valid until 2026.3
供稿与审核:临床开发与医学部
推荐阅读
-
-
肿瘤微环境分析阐释二线Axi-cel与SOC治疗LBCL的疗效差异
-
【2023 ASH】EBMT/Gocart真实世界数据:CD19 CAR-T细胞可有效治疗PCNSL和SCNSL患者
-
【2023 ASH】CIBMTR真实世界证据:LBCL患者在CR状态下接受CAR-T巩固治疗仍可获益
-
【2023 ASH】真实世界证据:CAR-T治疗R/R LBCL获益不受高龄影响
-
【2023 ASH】CAR-T治疗显著改善双打击/三打击淋巴瘤患者生存:早用更获益
-
【2023 ASH】CIBMTR真实世界证据:桥接治疗对Axi-cel治疗R/R LBCL的影响
-
单细胞RNA分析表明第三代CAR-T细胞的内在功能特征与淋巴瘤疗效相关
-
【2023 ASH】ZUMA-1研究6年随访生存数据:Axi-cel点亮难治性LBCL治愈之光
-
【2023 ASH】Axi-cel治疗LBCL:二线 vs 三线,早用更获益
-
【2023 ASH】CAR-T二线治疗R/R LBCL的真实世界证据
-
【2023 ASH】ZUMA-12的3年随访分析展示Axi-cel在一线高危LBCL患者治疗中的风采
-
【2023 ASH】真实世界中Axi-cel治疗LBCL患者的5年随访结局彰显治愈希望
-
【2023 ASH】Brexu-cel治疗R/R B-ALL成人患者的真实世界证据
-
【2023 ASH】CAR-T之声:一文速览Brexul-cel相关研究的最新进展
-
【ASH 2023】CAR-T细胞治疗重塑DLBCL患者的生存趋势
-
【2023 ASH】CAR-T之声:一文速览Axi-cel相关研究的最新进展
-
CAR-T细胞治疗合并肾功能减退的LBCL患者的真实世界结局
-
临床前研究提示来那度胺可改善第三代CD19 CAR-T细胞对DLBCL的疗效
-
【2023 ESMO】治疗3L+ R/R LBCL,Axi-cel vs Glofit,孰优孰劣?
-
Yescarta®全球上市6周年,为淋巴瘤患者点亮治愈的希望之光
-
奕凯达治疗R/R NHL继中国真实世界研究中期分析数据后再添亚裔人群证据,赵维莅等教授评论文章NEJM新发布!
-
CAR-T细胞治疗R/R LBCL的不良预后因素:欧洲 vs 美国患者
-
CAR-T治疗B-NHL的安全性和有效性不受合并自身免疫性风湿性疾病的影响
-
ctDNA可提高Axi-cel治疗R/R LBCL后PET的特异性
-
有效的桥接疗法可改善CAR-T治疗R/R LBCL患者的临床结局

