2024EHA & ASCO精彩回顾丨CAR-T探索应用新场景:原发纵膈或中枢侵犯
近来,备受全球瞩目的 2024 年美国临床肿瘤学会(ASCO)年会(5.31-6.4,美国芝加哥)、2024年欧洲血液病学会(EHA)年会(6.13-6.16,西班牙马德里)相继完美落幕。关于CAR-T细胞疗法的临床应用是今年ASCO & EHA的讨论焦点之一。CAR-T疗法成功应用为R/R LBCL的治疗带来了治愈曙光,也标志着细胞治疗时代的到来,而不断出现的新数据正在拓展CAR-T疗法的应用场景,为更多患者带来生存希望。围绕2024 ASCO&EHA最新进展,本期小编与您分享CAR-T疗法在B细胞淋巴瘤的新应用场景:1. 复发或难治性的原发纵膈B细胞淋巴瘤(PMBCL);2.复发或难治性的原发性或继发性中枢神经系统B细胞淋巴瘤(PCNSL或SCNSL)。
一
2024 EHA:Axi-cel治疗R/R PMBCL的疗效优于其他LBCL

原发性纵隔B细胞淋巴瘤(PMBCL)是大B细胞淋巴瘤(LBCL)的一种罕见亚型,复发或难治性(R/R)患者的结局很差1。2024年EHA大会上,Galtier J等报道了一项队列研究,共纳入法国DESCAR-T登记研究2018年10月-2023年3月期间接受CD19 CAR-T治疗的69例PMBCL患者。患者接受Axi-cel(n=55)或Tisa-cel(n=14)治疗。研究分析了患者的基线特征、桥接治疗、毒性、反应率、PFS和总生存期(OS)2。
表1. 基线特征

结果显示,在接受Axi-cel治疗的患者中,ORR为91%,CR率为80%,PR率为11%。中位随访20个月,1年PFS率为69%(95%Cl:58.6%-83.1%),1年OS率为86.5%(95%C1:79.7%-99.2%)。
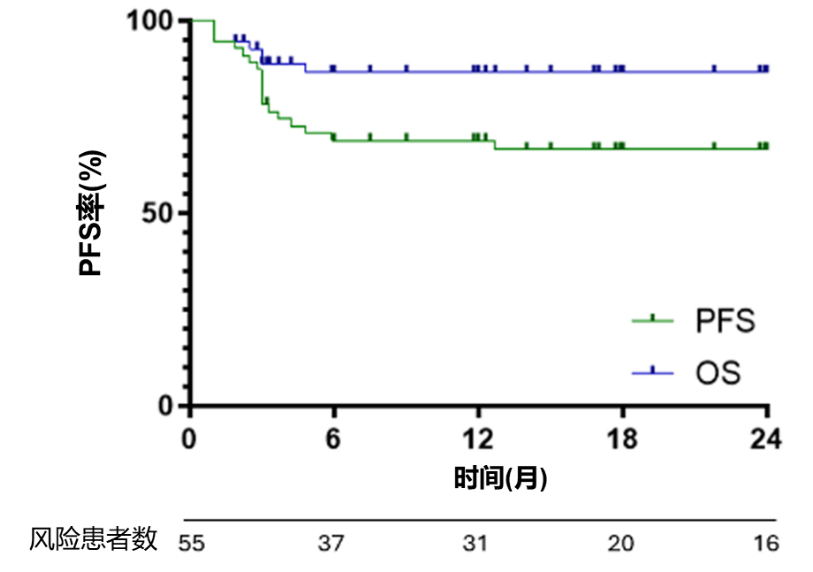
图1. Axi-cel治疗R/R PMBCL的OS和FPS
而接受Tisa-cel治疗的可评估患者中(n=12),只有4例患者(33%)达到CR,4例(33%)达到PR,1年PFS率和OS率分别为14%和49%。
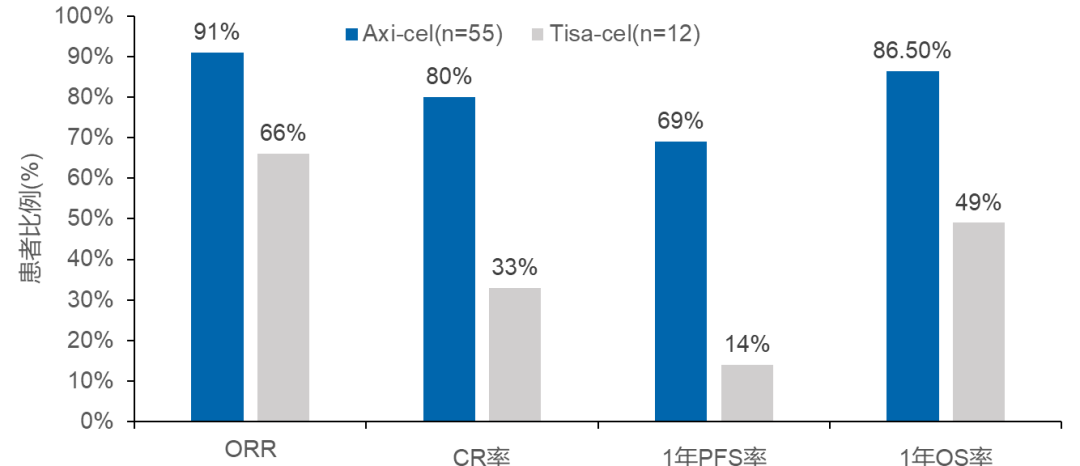
图2.Axi-cel vs. Tisa-cel的ORR、CR率、PFS率和OS率
此外,分析表明Axi-cel输注前对桥接治疗缺乏反应与复发风险增加无关(P = 0.61)。基线CRP> 30 mg/L与复发风险之间存在相关趋势(OR = 3.1,P= 0.09)。
该研究是迄今为止使用CD19 CAR-T治疗R/R PMBCL患者的最大队列研究。研究表明Axi-cel对R/R PMBCL具有较高疗效,且对桥接疗法应答差的患者也显示出良好的结果。此外,该研究Axi-cel组结果可能优于既往报道的其他LBCL患者(DESCART登记研究:ORR为80%,CR率为60%,1年PFS率为46.6%,1年OS率为63.5%)。
二
2024 ASCO:CAR-T可用于R/R PCNSL或SCNSL

原发性中枢神经系统淋巴瘤(PCNSL)是罕见类型的结外非霍奇金淋巴瘤,病灶范围局限于脑实质、脊髓、软脑膜和眼。PCNSL是所有非霍奇金淋巴瘤中预后最差的类型3。继发性中枢神经系统淋巴瘤(SCNSL)是指在初诊为全身性淋巴瘤时或在复发的情况下发生CNS受累,既可以是孤立性的,也可以是伴随着全身性疾病出现,是一种不常见但具有临床挑战性的事件,生存期较短4。
2024年ASCO大会上,Lakshmi等报道了一项探索性研究,纳入了18例既往至少接受过一次针对CNS系统性治疗后复发的PCNSL和SCNSL患者5。患者接受氟达拉滨(30mg/m2)+环磷酰胺(300mg/m2)进行淋巴细胞清除化疗,静脉输注Axi-cel剂量为2×106细胞/kg。主要终点是安全性,通过治疗限制性毒性(TLTs)发生率和3级以上不良事件发生率(AE)来衡量。次要终点包括ORR、CR/uCR、DOR、PFS和OS。探索性分析包括血清和脑脊液(CSF)中的Axi-cel和细胞因子水平;通过质谱流式细胞术(CyTOF)、流式细胞术和单细胞RNA测序(scRNA seg)检测外周血(PB)和CSF中的免疫细胞亚群,以及PB和CSF中的ctDNA。
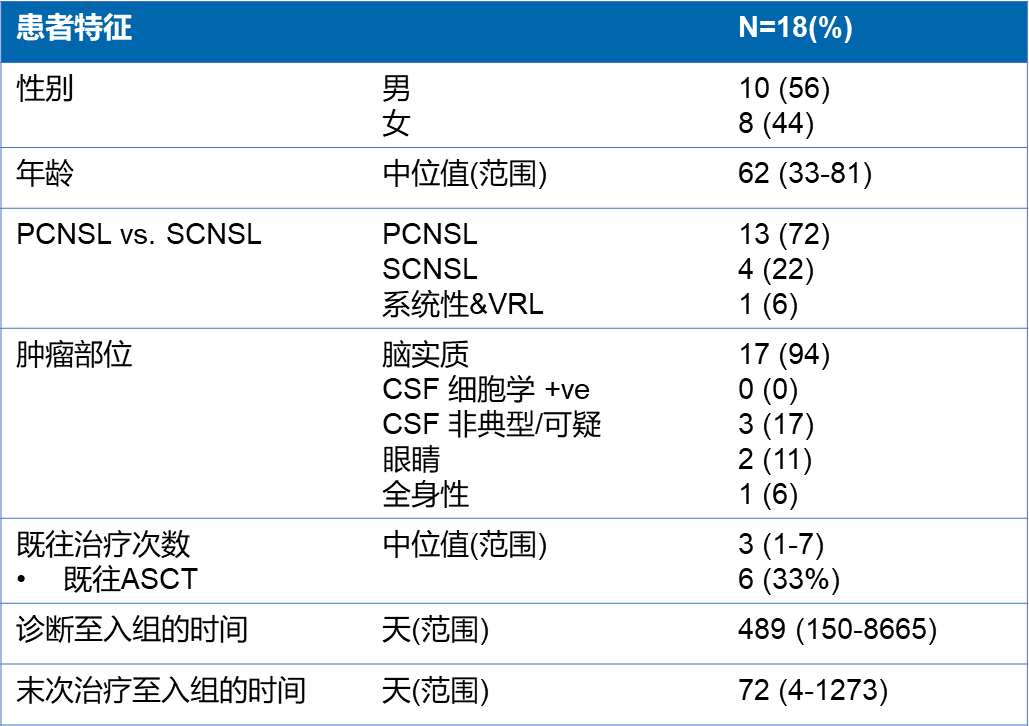
该研究共纳入18例患者(13例PCNSL,4例SCNSL,1例同时累及全身和眼部)。基线特征见表2。
表2.基线特征
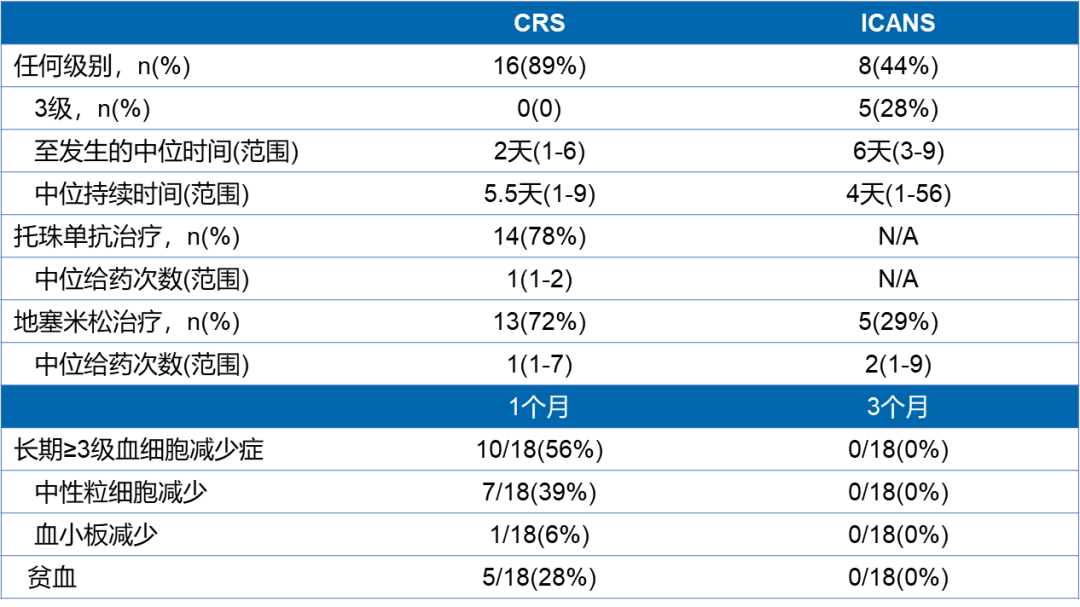
结果显示,所有患者中未观察到TLTs。16/18(89%)患者出现细胞因子释放综合征(CRS),未观察到3级CRS;8/18(44%)患者出现免疫效应细胞相关神经综合征(ICANS),5/18(28%)患者出现3级ICANS,未观察到4-5级ICANS(表3)。
表3.不良事件结果
该研究中,达到最佳缓解的中位时间为3个月。中位随访时间为24个月,ORR为94%,CR/uCR为67%;中位DOR为13.4个月(图3);中位PFS为14.3个月(95% CI:6.3-NR),中位OS为26.4个月(95% CI: 11.2-NR)(图4)。

图3.整体队列的DOR
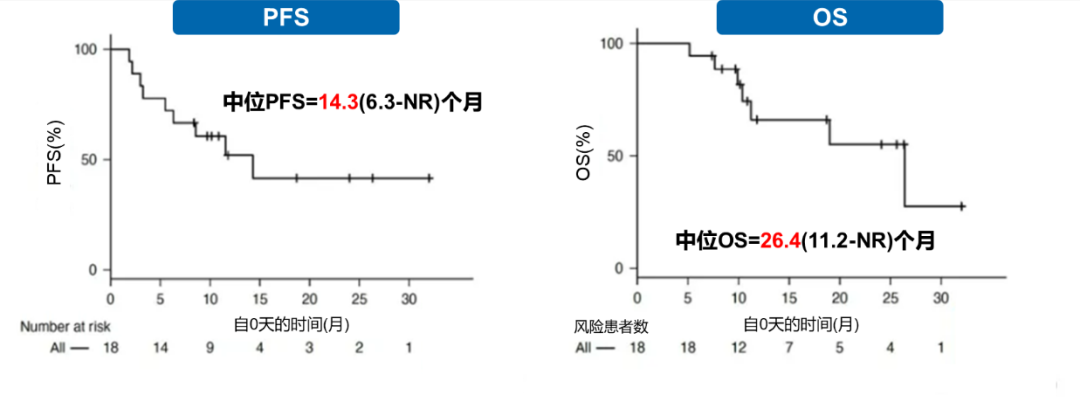
图4.整体队列的PFS和OS
分析显示,Axi-cel药代动力学与先前ZUMA-1研究中未累及中枢神经系统的弥漫性大B细胞淋巴瘤(DLBCL)患者相似。持续缓解的患者和≥2级ICANS患者具有更高的CAR-T细胞扩增(图5)。
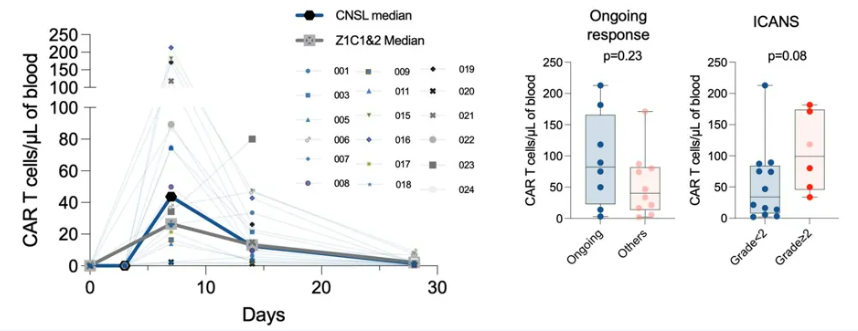
图5. CAR-T 细胞扩增
此外,高级别的ICANS(≥2级)与血清和CSF中生物标志物的基线及峰值水平相关。血清炎性细胞因子IL-6和髓系单核细胞趋化蛋白1(MCP1)的峰值水平与≥2级ICANS相关;出现≥2级ICANS患者的CSF的lL-15峰值水平也较高(图6),与LBCL的三线治疗相似。
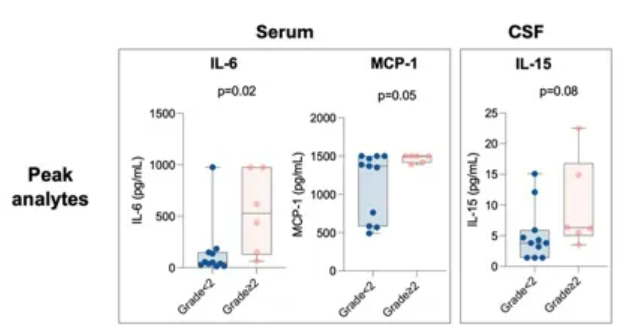
图6.血清和CSF中的生物标志物峰值水平与ICANS相关
而基线炎症细胞因子(血清Granzyme B、血清淀粉样蛋白A、CSF中的C反应蛋白)和血清IL-1Ra与≥2级ICANS相关(图7)。持续缓解的患者表现为血清炎性细胞因子lFN-g、IL-2和Granzyme B水平升高。对持续CR患者的CSF中CAR-T细胞分析显示,基因CD226和BACH2的表达增加。

图7. 血清和CSF中的基线生物标志物水平与ICANS相关
在这项前瞻性分析中,Axi-cel在CNSL患者中安全性可控、疗效良好,中位PFS和DOR均超过1年,且不会增加高级别ICANS 或脑水肿的风险。
三
总结
上述结果提示Axi-cel可作为(1)复发或难治性的原发纵膈B细胞淋巴瘤(PMBCL);(2)复发或难治性的原发性或继发性中枢神经系统B细胞淋巴瘤(PCNSL或SCNSL)的治疗方案,具有良好的疗效和可控的安全性。未来需要更大样本量的研究进一步确认临床获益。
参考文献

