一线高危LBCL患者ZR2方案诱导2个周期后CAR-T细胞治疗:疗效及安全性良好
大B细胞淋巴瘤(LBCL)是一种高度异质性的血液系统恶性肿瘤,约40%的LBCL患者在一线治疗后进展为复发/难治性(R/R)LBCL[1]。嵌合抗原受体T(CAR-T)细胞疗法是一种通过基因工程技术把CAR结构修饰于患者自身T细胞,然后回输至患者体内,以实现抗肿瘤效应的免疫治疗手段[2,3]。目前CAR-T细胞已在R/R LBCL中取得了突破性进展,但用于治疗初诊高危LBCL患者的数据仍然很少。本文旨在报道一篇在2024年美国血液学会(ASH)年会上发布的口头汇报:ZR2(利妥昔单抗、来那度胺和泽布替尼)2周期诱导治疗后CAR-T细胞治疗在初诊高危LBCL患者中的临床结局,以期为临床提供参考。
研究背景
CAR-T细胞已在初诊高危LBCL中表现出显著疗效和安全性。一项多中心、单臂、Ⅱ期研究,共纳入40例初诊高危LBCL患者接受CAR-T细胞治疗,中位随访40.9个月时,客观缓解率(ORR)为92%,完全缓解(CR)率为86%,36个月的无进展生存期(PFS)率和总生存期(OS)率分别为75%和81%,中位随访15.9个月到中位随访40.9个月期间,未发生新的细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。提示CAR-T细胞疗法可能对既往治疗较少和初诊高危LBCL患者有益[4]。
但部分患者对CAR-T细胞疗法前的化疗不耐受,特别是高龄和体力状况差的患者。既往一项II期研究首次在化疗前使用靶向药物联合治疗初诊弥漫性大B细胞淋巴瘤(DLBCL)患者。该研究共纳入60例初诊非生发中心B细胞(non-GCB)亚型的DLBCL患者,接受利妥昔单抗、来那度胺和伊布替尼(RLI)序贯化疗。结果显示,RLI治疗2个周期后,ORR为86.2%,CR率为36.2%,部分缓解(PR)率为50%。提示初诊DLBCL患者可以在化疗前接受靶向药物联合治疗[5]。
2024年ASH大会公布了一项新的临床研究,报道了ZR2诱导2周期后CAR-T细胞治疗初诊高危LBCL患者的疗效与安全性[6,7]。
研究设计
该研究是一项单臂、II期、研究者发起的临床研究(llT)。患者入组资格标准为初诊高危LBCL成人患者、淋巴瘤细胞表达CD19和CD20、美国东部肿瘤协作组体力状况(ECOG PS)评分为0-2分、器官功能完整和无中枢神经系统(CNS)受累。高危LBCL包括伴有MYC和BCL2和/或BCL6重排的高级别B细胞淋巴瘤(HGBL),高级别B细胞淋巴瘤-非特指型(HGBL-NOS),以及国际预后指数(IPI)评分≥3分的DLBCL-NOS。
患者接受了2个周期的ZR2诱导治疗(利妥昔单抗375mg/m2,d1,来那度胺25mg 每日1次 d1-21,泽布替尼160mg 每日2次 d1-28),随后接受了CD19 CAR-T 细胞治疗。研究主要终点为CAR-T细胞治疗后的CR率,次要终点包括PFS、OS和安全性。
入组人群
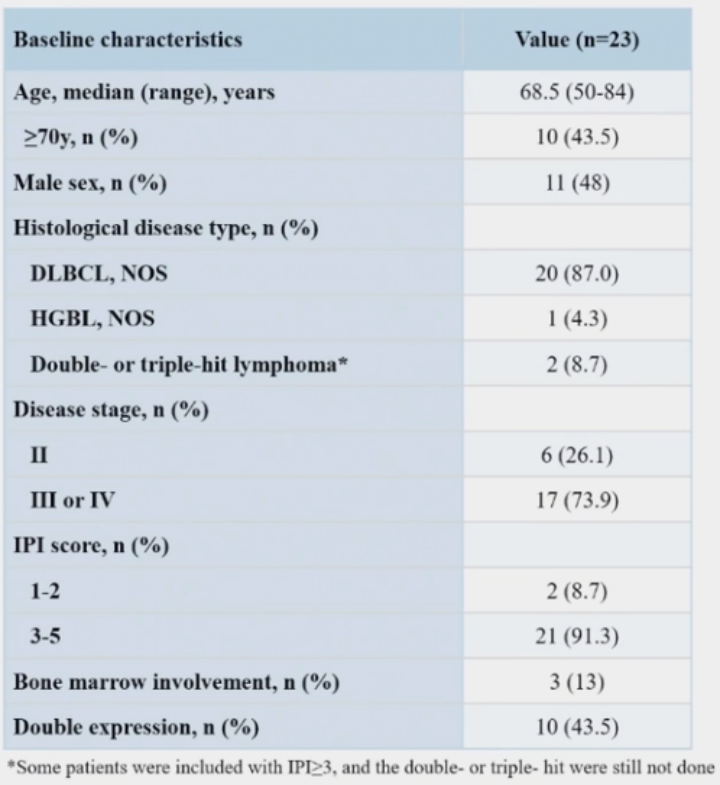
研究共纳入23例患者接受2个周期的ZR2治疗,其中18例患者接受CAR-T细胞治疗,4例患者未进行疗效评估,1例患者撤回知情同意。患者基线特征见表1。
表1 初诊高危LBCL患者的基线特征
疗 效
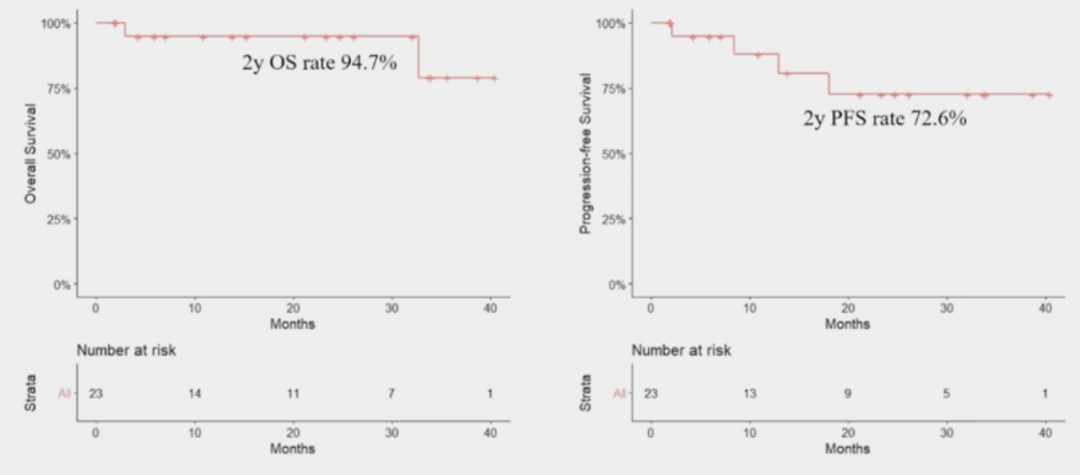
23例患者接受2个周期的ZR2治疗后,CR率为30.4%(7/23),PR率为65.2%(15/23),疾病进展(PD)率为4.3%(1/23,撤回知情同意)。CD19 CAR-T细胞回输后,CR率为94.4%(17/18),疾病稳定(SD)率为5.6%(1/18,随后因PD死亡)。中位随访时间为24个月时,2年OS率为94.7%,2年PFS率为72.6%(表2)。
表2 初诊高危LBCL患者的OS和PFS率
安全性
在CAR-T细胞治疗后,仅5例患者发生1级CRS,未有患者发生≥2级CRS和任何等级ICANS。最常见的≥3级不良事件(AE)是血液学毒性(与清淋化疗有关),无需输血即可在短时间内恢复,无长期血细胞减少症发生。未有因AE导致的死亡。
研究结论
在初诊断高危LBCL患者中,ZR2诱导治疗2周期后CAR-T细胞输注是一种无化疗(chemo-free)方案,具有高CR 率、可管理的毒性、较短的治疗周期和较长的生存期,为开发生物驱动且无化疗毒性的 LBCL 一线疗法提供了新的选择。未来,随着更多临床试验的开展和数据的积累,这种‘chemo-free’的治疗方案有望进一步优化和推广。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2025.1-15 valid until 2027.1
供稿与审核:临床开发与医学部

