增强型CAR-T细胞疗法在非霍奇金淋巴瘤治疗中的探索
抗CD19的嵌合抗原受体T(CAR-T)细胞疗法已经改变了B细胞恶性肿瘤的治疗格局,但部分患者的长期缓解效果有待进一步提升,主要原因包括T细胞功能障碍和免疫抑制性肿瘤微环境。这一现状凸显了对具有增强效应功能的CAR-T细胞的迫切需求。有研究团队开发了一种新型的huCART19-IL18细胞产品。该产品通过持续分泌白细胞介素-18(IL-18)来增强抗肿瘤活性。IL-18作为一种促炎细胞因子,能够有效激活T细胞和自然杀伤细胞,促进干扰素-γ(IFN-γ)分泌,从而改善肿瘤微环境。该产品采用快速的3天制备工艺,可更好地保留T细胞的干细胞样特性,减少T细胞耗竭。同时,整合的人源化抗CD19单链可变区片段降低了免疫原性,提高了CAR-T细胞的体内持久性。《The New England Journal of Medicine》近期发表了此项关于huCART19-IL18细胞的临床研究。研究主要目的是评估huCART19-IL18的安全性和最大耐受剂量,次要目的是评估制备可行性、初步疗效,以及huCART19-IL18扩增能力、持久性、细胞因子水平和应答的组织相关性[1]。
研究设计
该研究为一项I期临床试验,共纳入21例CD19 CAR-T细胞治疗失败的CD19+ 非霍奇金淋巴瘤(NHL)患者接受huCART19-IL18治疗,病理亚型包括:12例大B细胞淋巴瘤(LBCL:8例弥漫大B细胞淋巴瘤非特指型,2例转化型滤泡性淋巴瘤,1例高级别B细胞淋巴瘤,1例富于T细胞/组织细胞大B细胞淋巴瘤),6例滤泡性淋巴瘤(FL)和3例套细胞淋巴瘤(MCL)。huCART19-IL18以五个剂量水平给药,从剂量水平1(3×106个细胞)到剂量水平5(3×108个细胞)。根据Lugano 2014标准,患者在huCART19-IL18回输后3个月进行首次疗效评估,随后第一年每3个月评估一次,之后转入长期随访。
疗 效
中位"静脉到静脉"时间为67天。huCART19-IL18回输后3个月的客观缓解率(ORR)为81%,其中完全缓解(CR)率为52%,部分缓解(PR)率为29%。NHL亚型均观察到缓解:LBCL为67%,FL为 100%,MCL为 100%(图1)。
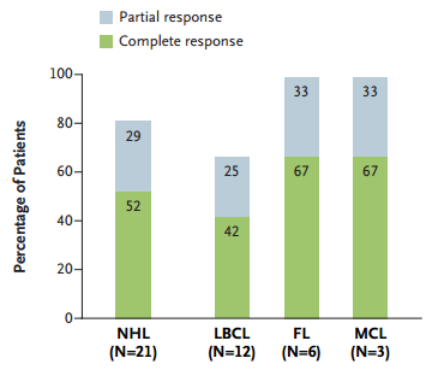
图1 NHL及亚型患者的回输后3个月的缓解情况
中位随访17.5个月时,中位缓解持续时间(DOR)为9.6个月,中位无进展生存期(PFS)为8.7个月。回输后15个月时10例(48%)患者存活,估计的总生存(OS)率为86%。随访2年时,3例患者(2例LBCL和1例FL)持续缓解。在12例疾病进展患者中,仅1例患者CD19阴性,3例为CD19低表达。
安全性
任何等级细胞因子释放综合征(CRS)发生率为62%,最高等级为3级(14%)。CRS中位发生时间为回输后第4天,中位持续时间为7天。33%患者接受托珠单抗治疗,10%患者在重症监护室接受治疗。2-3级CRS与血液中较高的huCART19-IL18扩增水平相关。
任何等级免疫效应细胞相关神经毒性综合征(ICANS)发生率为14%(均为1-2级)。ICANS中位发生时间为回输后第8天,中位持续时间为7天。未发生与治疗相关死亡或剂量依赖性毒性差异,也未发生噬血细胞性淋巴组织细胞增生症样综合征有关的毒性作用。
剂量探索
根据试验设计,最高剂量水平(3×10⁸ 个转导的huCART19-IL18细胞)将是剂量限制性毒性最接近30%的最大耐受剂量。但该剂量水平未达可行性终点,仅治疗2例后停止使用。通过加权多标准决策分析,huCART19-IL18阳性细胞的剂量范围为3×106-7×106,用于该患者群体的扩展队列和未来试验。
huCART19-IL18特性与相关研究
huCART19-IL18在所有剂量水平下均表现出强大的扩增能力(图2)。外周血检测证实该细胞产品具有持久性:在4例可评估患者中,3例(75%)在随访2年时仍能检测到huCART19-IL18细胞存在。
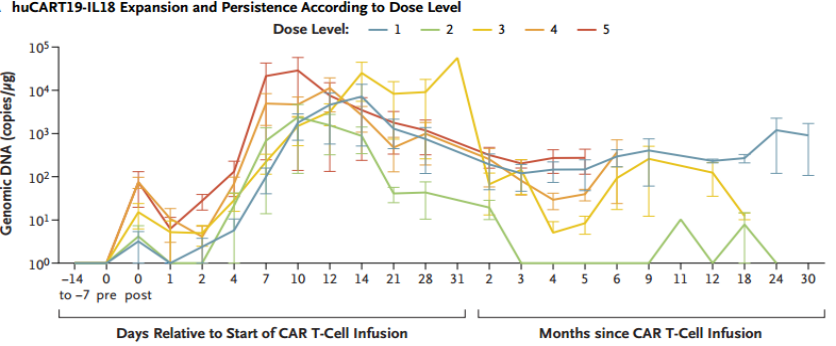
图2 不同huCART19-IL18剂量水平下,外周血中基因组DNA的拷贝数
第14天穿刺活检样本显示,64%通过qPCR检测到huCART19转基因表达,免疫组化显示存在密集的CD3+T细胞浸润。
游离IL-18活性受高亲和力IL-18结合蛋白(IL18BP)的调控。血清分析显示,尽管游离IL-18水平维持稳定(可能是由于IL18BP快速结合),但IL-18-IL18BP复合物水平显著升高(图3),且与CAR-T细胞扩增水平高呈正相关。这种IL-18-IL18BP复合物的特异性升高仅在huCART19-IL18治疗后出现,而在相同患者接受常规CD19 CAR-T细胞治疗的历史样本中未观察到。此外,与2例患者的既往CD19 CAR-T细胞产品相比,huCART19-IL18产品中初始T细胞(CD45RA+CCR7+)比例升高。
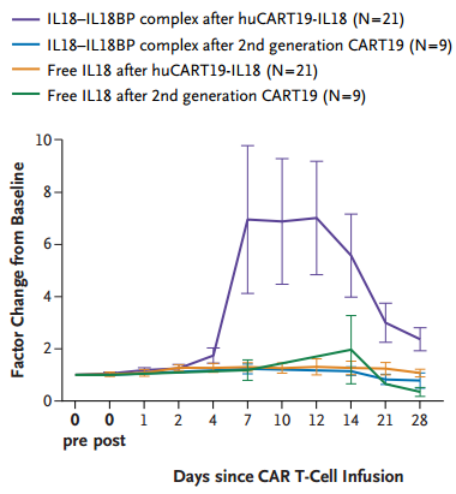
图3 CD19 CAR-T细胞和huCART19-IL18治疗后游离IL-8和IL-18-IL18BP复合物水平较基线变化
临床前小鼠研究数据证实,采用相同3天和9天制备工艺的增强型huCART19-IL18与非增强型huCART19相比,展现出更优的肿瘤抑制作用和生存期延长。
这些研究结果共同支持以下科学假设:huCART19-IL18装载IL-18可通过增强局部免疫激活、促进CAR-T细胞扩增及提升抗肿瘤效能来改善治疗效果。
小 结
装载IL-18的自体CAR-T细胞(huCART19-IL18)在既往抗CD19 CAR T细胞治疗失败的CD19+淋巴瘤患者中展现出良好疗效。治疗相关不良事件以1-2级为主,未出现非预期毒性。虽然方案设计导致中位"静脉至静脉"时间为67天,但采用3天快速制备工艺可能进一步减少治疗延迟。随访数据显示,huCART19-IL18在患者体内呈现持续扩增,部分病例维持可达2年。本项研究不仅验证了细胞因子装甲CAR-T细胞的临床可行性,更证实其在保持良好安全性的同时可显著增强抗肿瘤效能。这种将细胞因子分泌功能整合至CAR-T细胞的设计策略,为拓展细胞疗法在血液系统恶性肿瘤及其他领域的应用提供了新的研究方向。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2025.5-23 valid until 2027.5
供稿与审核:临床开发与医学部

