【2023 ASH】ZUMA-12的3年随访分析展示Axi-cel在一线高危LBCL患者治疗中的风采
2023年第65届美国血液学会(ASH)年会于美国东部时间12月9日至12日在San Diego举行。ASH年会是全球血液学领域的国际盛会,本届大会汇集了各国知名血液病学专家最新的重要研究成果,已经公布7,000余篇已接受的摘要,其中CAR-T细胞治疗相关摘要超470篇[1]。
大B细胞淋巴瘤(LBCL)占全球非霍奇金淋巴瘤所有新诊断病例的40%,。虽然约60% 的LBCL患者对标准一线化学免疫治疗方案有反应,但高危LBCL患者的结局较差。靶向CD19的嵌合抗原受体T细胞(CAR-T)疗法在治疗复发/难治性B细胞淋巴瘤(包括LBCL、套细胞淋巴瘤和滤泡性淋巴瘤)方面显示出可控的安全性和疗效[2]。
在诸多摘要中,小编节选了一篇关于“2期研究ZUMA-12的3年随访分析”(Oral #894),让我们一睹Axi-cel一线治疗高危LBCL患者的疗效。
摘要编号:894
英文标题:3-Year Analysis of ZUMA-12: A Phase 2 Study of Axicabtagene Ciloleucel (Axi-Cel) As First-Line Therapy in Patients with High-Risk Large B-Cell Lymphoma (LBCL)Clinically Relevant Abstract[3]
中文标题:ZUMA-12的3年随访分析:Axi-Cel作为高危LBCL患者的一线治疗的2期研究
研究背景
Axicabtagene Ciloleucel(Axi-cel)是一种自体抗CD19 CAR-T细胞疗法,已被批准用于治疗R/R LBCL[4,5]。ZUMA-12研究是一项II期、多中心、单臂研究,旨在评估Axi-cel一线治疗高危LBCL患者的疗效。中位随访时间15.9个月时,Axi-cel表现出较高的完全缓解率(CR,78%;95%CI,62%-90%)和客观缓解率(ORR,89%;95%CI,75%-97%)。Axi-cel安全性可控,在一线治疗未观察到新的安全信号[2]。与ZUMA-1研究相比, ZUMA-12研究中观察到Axi-cel产品中分化程度较低的CCR7+CD45RA+T细胞亚型占比更高, CAR-T细胞扩增中位峰值更高[2,6]。本研究报告了ZUMA-12研究中位随访≥40个月的最新疗效数据和安全性结果。
研究方法
纳入≥18岁、美国东部肿瘤协作组体能状态评分(ECOG PS)为0-1的高危LBCL成人患者。高级别B细胞淋巴瘤指伴有MYC和BCL2和/或BCL6重排(组织学为双重或三重打击型[DHL/THL])或国际预后指数 (IPI) 评分≥3。对患者进行动态风险评估,根据Lugano标准 [7]的PET-CT呈阳性(抗CD20单克隆抗体和含蒽环类药物治疗方案2个周期后,Deauville评分为4-5分)。患者接受白细胞单采,然后在第-5、-4和-3天进行清淋化疗(环磷酰胺[500 mg/m2,IV]和氟达拉滨[30 mg/m2,IV]),并在第0天接受单次Axi-cel输注2×106 CAR-T细胞/kg。根据研究者的判断,可进行非化疗桥接。主要终点为研究者根据Lugano标准评估的CR率。次要终点包括ORR、缓解持续时间(DOR) 、无事件生存期(EFS)、无进展生存期(PFS)、总生存期(OS)、安全性以及血液中CAR-T细胞和血清中细胞因子的水平。
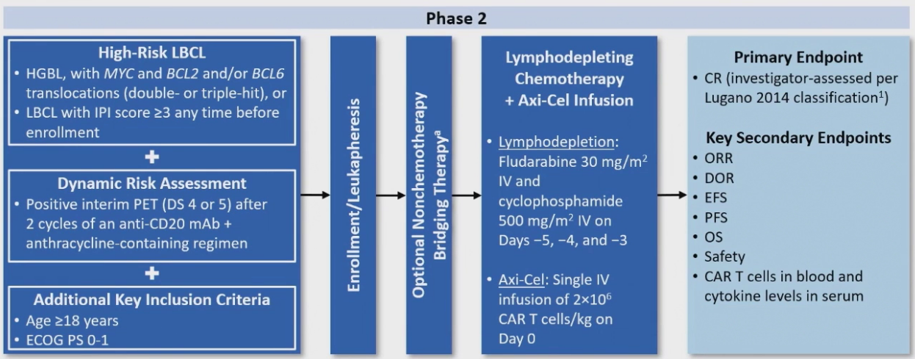
图1 研究设计
研究结果
截至2023年5月3日,40例患者接受了Axi-cel治疗,中位随访时间为40.9个月(范围,29.5-50.2个月)。由研究人员根据Lugano-标准进行评估,共有37例患者可进行疗效评估。表1,图2)。
在可评估疗效的患者中,由于从部分缓解(PR)转为CR的患者数量增加,CR率略高于初步分析。在数据截止时,可评估缓解患者中73%仍保持持续缓解。
表1 缓解情况
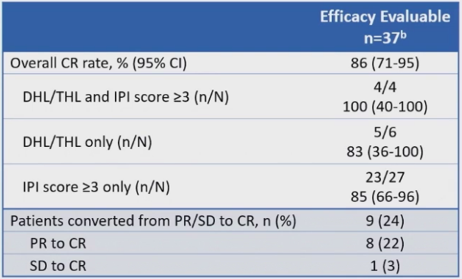
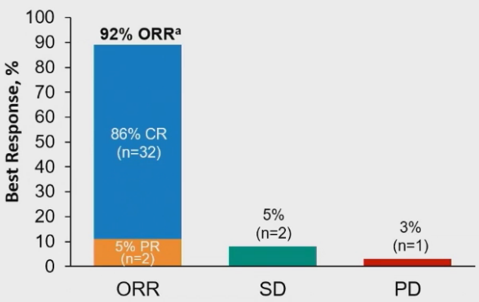
图2 最佳缓解情况
自初步分析以来,经过长期随访,中位DOR未达到。最佳缓解为CR患者的3 年DOR率为84.4%(95%Cl,66.5%-93.2%)(表2,图3)。
表2 DOR
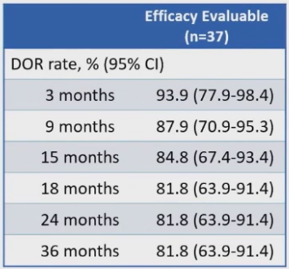
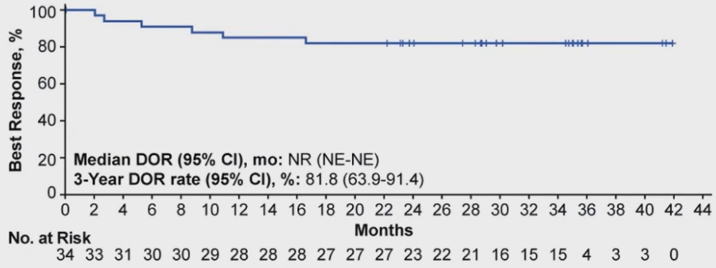
图3 DOR
可评估疗效的患者中位EFS未达到;3年EFS率为73%(95%Cl,55.6%-84.4%),曲线在第18个月出现平台期。最佳缓解为CR患者的3年EFS率为84.4%(95%Cl,66.5%-93.2%)(表3,图4和5)。
表3 EFS
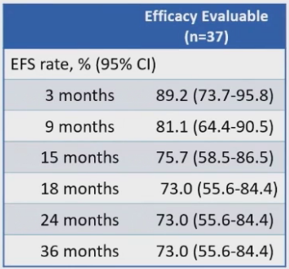
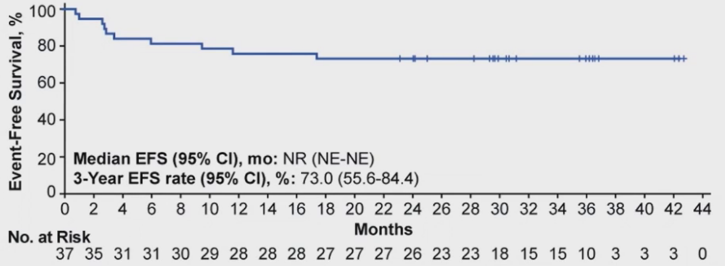
图4 EFS
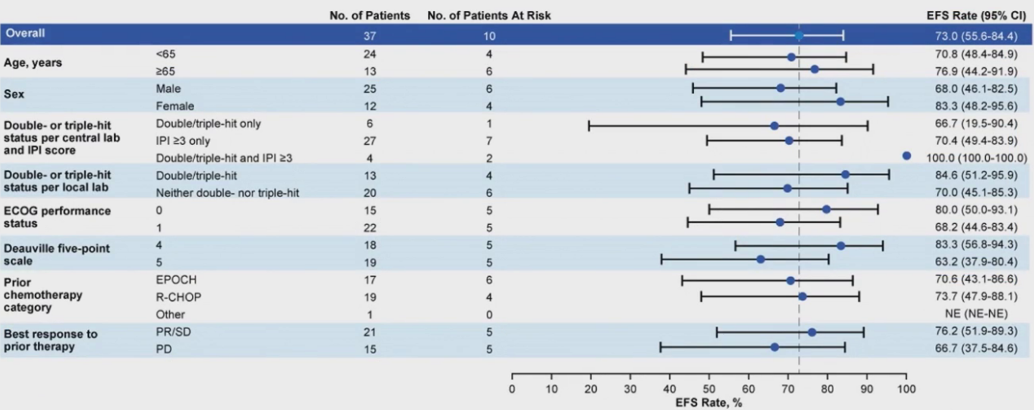
图5 主要LBCL亚组36个月的无事件生存率
可评估疗效患者的中位PFS和中位OS未达到。最佳缓解为CR患者的3年PFS和OS率分别为84.4%(95%CI, 66.5%-93.2%)和90.6%(95%CI, 73.6%-96.9%)(图6,7)。
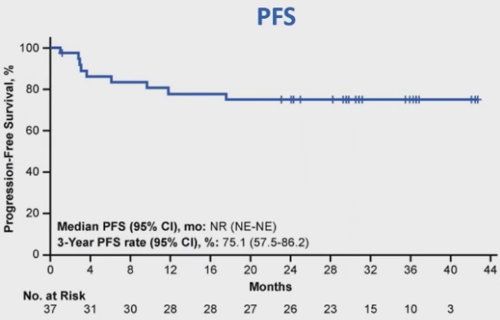
图6 PFS

图7 OS
对所有接受Axi-cel的患者进行安全性分析(n=40)。自数据截止后,未发生新的细胞因子释放综合征(CRS)或任意级别的神经系统事件,并且既往报告的所有病例在数据截止时均已缓解。自初步分析以来,仅1患者发生了1起任意级别的持续性血细胞减少症,并在数据截止时已缓解。
在30个月数据截止时仍保持持续PR/CR的患者中(n=27),输注后CAR-T细胞扩增峰值和AUC0-28中位数分别为35.7细胞/uL和368.0细胞/uL/天。在复发者 (n=6) 中,输注后CAR-T细胞扩增峰值和AUC0-28的中位数分别为45.1细胞/uL和413.4细胞/uL/天,在未缓解者中分别为34.7细胞/uL和566.8细胞/uL/天(n=3)(图8,9)。
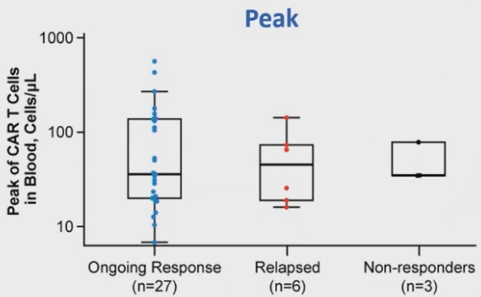
图8 扩增峰值
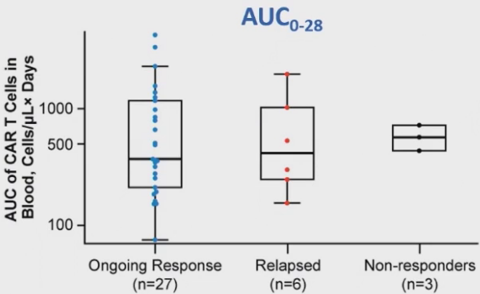
图9 AUC0-28
研究结论
在ZUMA-12的最新分析中,Axi-cel表现出较高的持久缓解率。在数据截止时,中位随访时间>40个月,73%的可评估缓解的患者仍保持持续缓解。中位DOR、EFS、PFS和OS均未达到。
安全性结果与既往报告的结果相当,未观察到新的安全信号。CAR-T细胞扩增达到峰值,AUC0-28与主要分析一致。
本项研究结果证实,Axi-cel可使既往接受过较少治疗的患者和高危LBCL患者受益,这些患者在标准一线化学免疫疗法后需求未得到满足且预后不佳。进一步证实了Axi-cel在高危LBCL患者一线治疗的潜力。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2023.12-15-2 valid until 2025.12
供稿与审核:临床开发与医学部
推荐阅读
-
【2023 ASH】真实世界中Axi-cel治疗LBCL患者的5年随访结局彰显治愈希望
-
【2023 ASH】Brexu-cel治疗R/R B-ALL成人患者的真实世界证据
-
【2023 ASH】CAR-T之声:一文速览Brexul-cel相关研究的最新进展
-
【ASH 2023】CAR-T细胞治疗重塑DLBCL患者的生存趋势
-
【2023 ASH】CAR-T之声:一文速览Axi-cel相关研究的最新进展
-
CAR-T细胞治疗合并肾功能减退的LBCL患者的真实世界结局
-
临床前研究提示来那度胺可改善第三代CD19 CAR-T细胞对DLBCL的疗效
-
【2023 ESMO】治疗3L+ R/R LBCL,Axi-cel vs Glofit,孰优孰劣?
-
Yescarta®全球上市6周年,为淋巴瘤患者点亮治愈的希望之光
-
奕凯达治疗R/R NHL继中国真实世界研究中期分析数据后再添亚裔人群证据,赵维莅等教授评论文章NEJM新发布!
-
CAR-T细胞治疗R/R LBCL的不良预后因素:欧洲 vs 美国患者
-
CAR-T治疗B-NHL的安全性和有效性不受合并自身免疫性风湿性疾病的影响
-
ctDNA可提高Axi-cel治疗R/R LBCL后PET的特异性
-
有效的桥接疗法可改善CAR-T治疗R/R LBCL患者的临床结局
-
ZUMA-1研究5年随访数据尽显Axi-cel风采,R/R LBCL治愈未来可期
-
真实世界中白细胞单采至输注时间对接受Axi-cel治疗R/R LBCL患者结局的影响
-
Axi-cel用于桥接治疗后达到完全代谢缓解的R/R LBCL患者的结局
-
【2023EHA】Axi-cel与其他CAR-T产品治疗R/R LBCL的白细胞单采至输注时间:一项系统性综述与荟萃分析
-
【2023EHA】早期Pola桥接CD19 CAR-T细胞治疗是改善复发难治B细胞淋巴瘤患者生存的有效策略
-
【EHA & ICML】Axi-cel作为不适合移植LBCL患者的二线治疗:LYSA Ⅱ期研究ALYCANTE的最终分析

