EHA新浪潮┃CAR-T一线治疗迈向现实的临床考量

仲夏之约,共赴未来,2024年6月13日~6月16日欧洲血液学协会(EHA)大会完美落幕,会上由CAR-T之父Carl June教授领衔,多位专家共同讨论了CAR-T疗法的未来发展方向:“How will CAR-T evolve in the future?”。
上一期我们分享了Claire Roddie博士关于CAR-T用于一线治疗原因的报告(详见EHA新浪潮┃CAR-T疗法治疗LBCL为什么要向一线推进?)。本期小编与您分享的是Jason Westin博士(美国安德森癌症中心)的精彩报告:“Making 1L CAR T a reality: Clinical considerations(CAR-T一线治疗迈向现实的临床考量)”。内容主要围绕大B细胞淋巴瘤一线治疗的现状和未满足需求,并分析了CAR-T作为高危LBCL患者一线治疗的应用前景。


一
DLBCL一线(1L)治疗现状
长期以来,R-CHOP方案是DLBCL一线治疗经典方案。但仅约60%的患者能够通过一线治疗实现治愈,约22-31%的患者会出现复发,12%的患者原发难治1。而将R-CHOP方案中的长春新碱替换为维泊妥珠单抗(Pola-R-CHP)作为一线治疗,尽管2年PFS率显著高于R-CHOP方案(76.7% vs. 70.2%,HR=0.73,P=0.02),但2年总生存率无显著差异(88.7% vs. 88.6%,HR=0.94,P = 0.75)2。
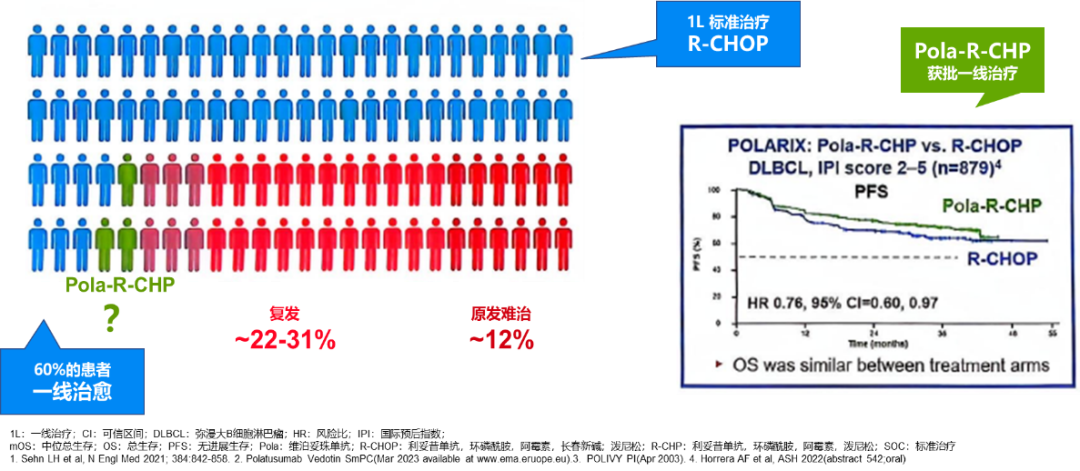
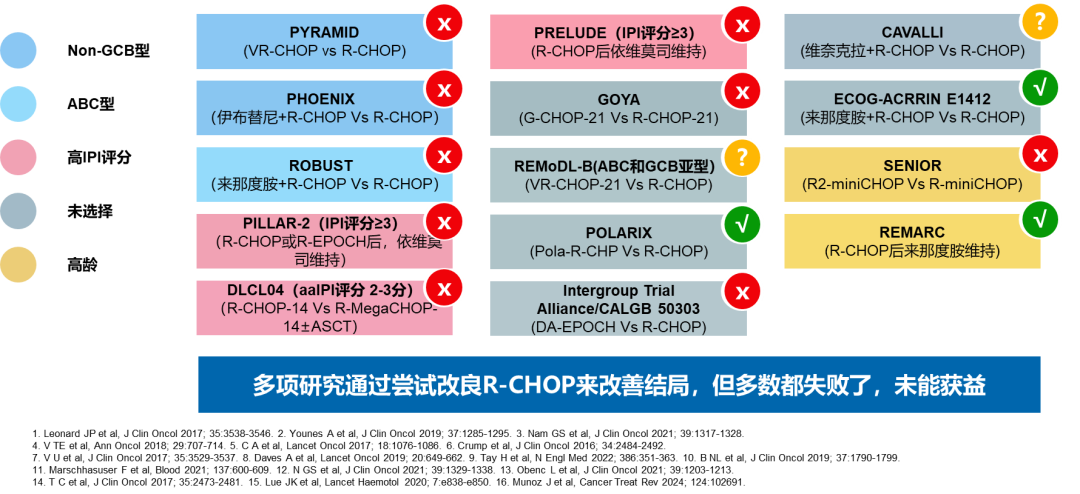
近年来,多项临床试验还尝试在标准R-CHOP方案的基础上,通过提高剂量强度、强化化疗或联合其他药物(如伊布替尼、来那度胺、依维莫司等)以提高疗效,但多数未能显著改善患者预后。这表明DLBCL的一线治疗仍存在未满足需求,需要新的治疗方法来提高治愈率。
二
DLBCL一线治疗的迫切未满足需求:高危患者
DLBCL具有高度异质性,不同个体的临床特征、遗传学改变、免疫表型等存在差异,对免疫化疗方案的反应也不相同3。筛选存在高危因素患者,并给予适当的治疗,是提高治愈率的关键。迫切需要建立精确的预后模型对患者分层,以开发更加个体化的DLBCL治疗方案。随着分子病理学及临床技术的发展,越来越多有意义的临床及分子病理预后因素被发现,主要包括:国际预后指数(IPI)、双打击、细胞起源、基因分型、中期PET评估、ctDNA。

1. IPI评分可以用来识别复发的高危患者吗?
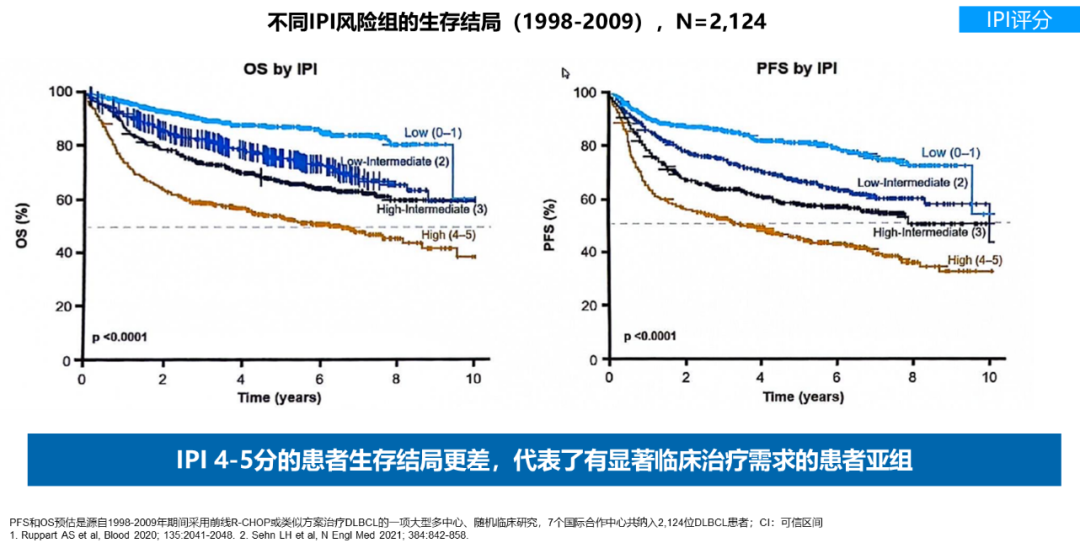
IPI 评分根据患者的年龄、体能状态、临床分期、结外器官受累数目、乳酸脱氢酶等5个因素,将DLBCL患者分为4个危险组(低危、低中危、高中危、高危),广泛应用于 DLBCL 预后预测4。研究显示,不同IPI风险组的生存结局存在显著差异,特别是IPI评分为4-5分的患者,其生存结局更差5,6,是一个有显著临床治疗需求的患者亚组。
2. 伴双打击的HGBL患者预后较差?
2016年修订的世界卫生组织(WHO)淋巴瘤分类将伴有c-MYC、BCL-2及BCL-6基因重排的定义为双打击淋巴瘤(DHL)及三打击淋巴瘤(THL)7。伴双打击(DH)的高级别B细胞淋巴瘤(HGBL)患者,特别是那些伴MYC和BCL2/BCL6易位的患者,通常预后较差,且更易发生中枢神经系统(CNS)侵犯8-11。R-CHOP方案对DHL的治疗效果并不理想7。DA-EPOCH-R是双打击淋巴瘤最广泛应用的方案。回顾性分析显示,DA-EPOCH-R在未经治疗的双打击淋巴瘤患者中疗效优于R-CHOP方案12,13。
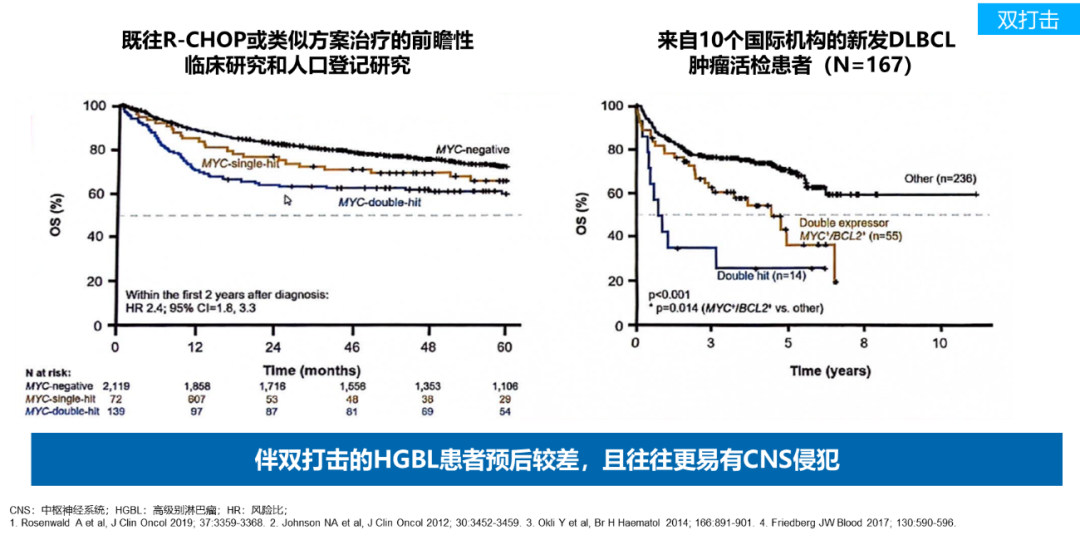
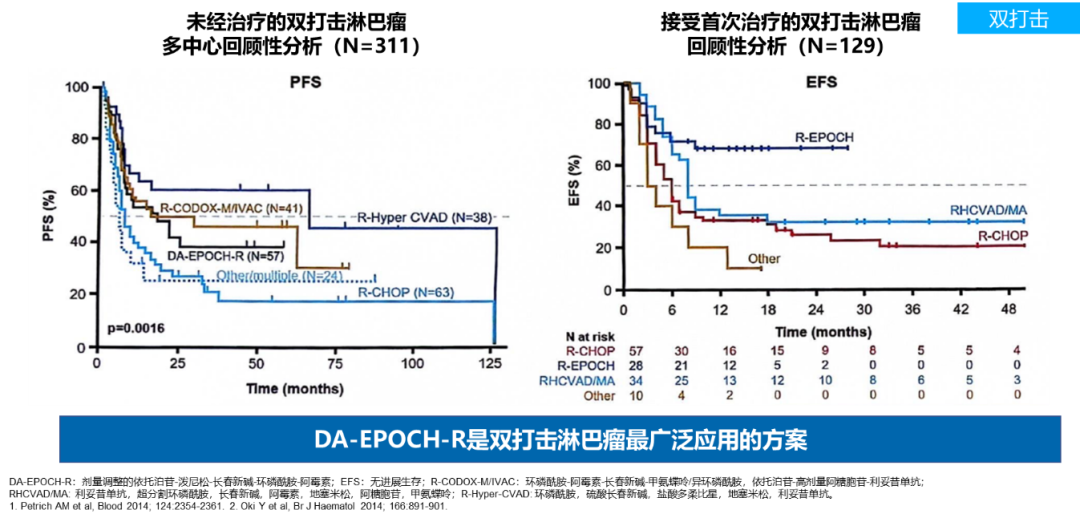
以上数据强调对高危LBCL患者进行精准识别和分层治疗的重要性。对于IPI评分4-5分、伴有双打击或三打击HGBL患者的预后较差,治疗需求更加迫切。
三
CAR-T是否能满足高危患者的一线治疗需求?
1. 1L治疗的新选择
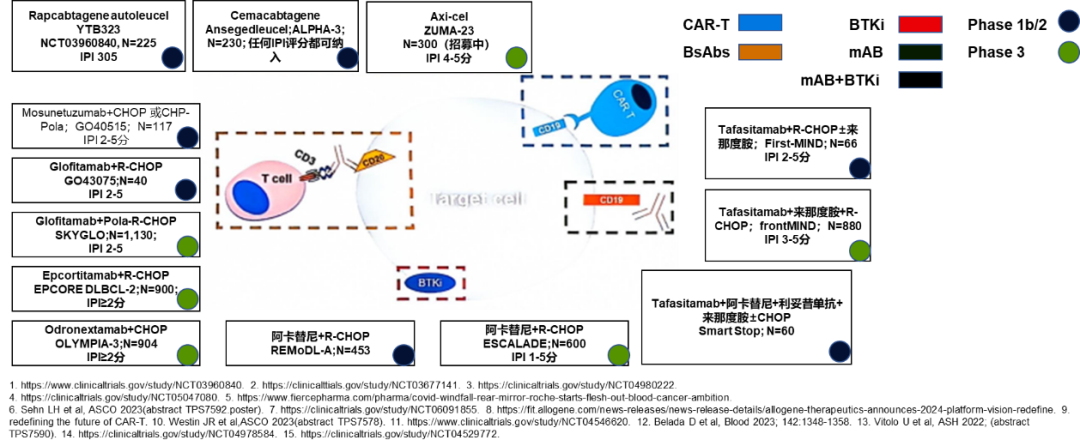
目前DLBCL治疗的探索如火如荼,针对DLBCL的一线治疗的新选择包括嵌合抗原受体T细胞(CAR-T)疗法、双特异性抗体(BsAbs)、布鲁顿酪氨酸激酶抑制剂(BTKi)和单克隆抗体(mAb)等。尽管这些疗法尚在临床研究阶段,但已展现出改变DLBCL治疗格局的潜力。Jason Westin博士特别提到了几种CAR-T疗法,如Axi-cel(ZUMA-23研究)和Cema-cel(ALPHA-3研究)在1L高危患者中的应用前景。
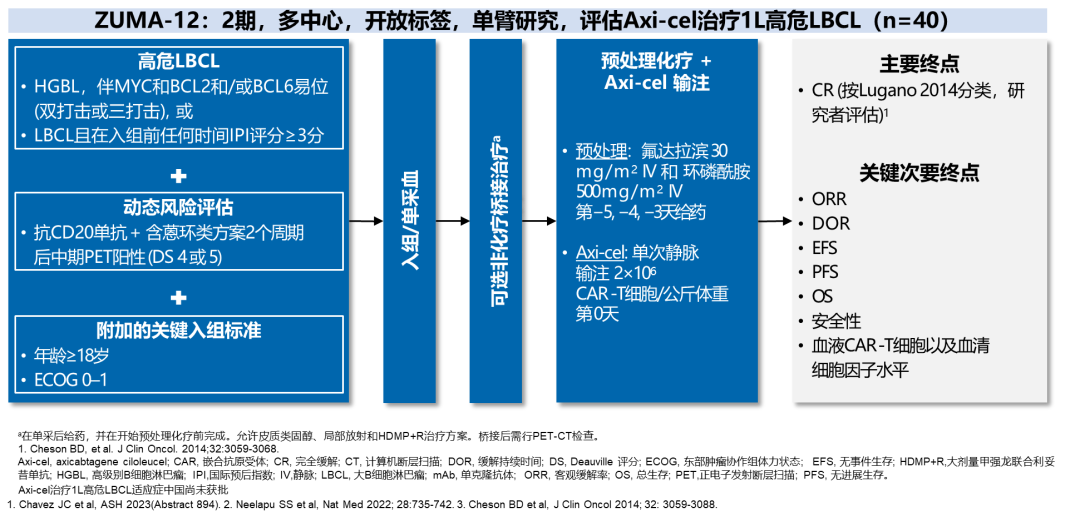
2. ZUMA-12:针对1L高危LBCL患者CAR-T治疗的研究
ZUMA-12是一项2期、多中心、开放标签、单臂研究,评估了Axi-cel对40例1L高危大B细胞淋巴瘤(LBCL)患者的疗效。患者接受氟达拉滨和环磷酰胺的预处理化疗,随后在第0天接受Axi-cel的单次静脉输注。主要终点为完全缓解率(CR),关键次要终点包括客观缓解率(ORR)、缓解持续时间(DOR)、无事件生存(EFS)、无进展生存(PFS)、总生存(OS)和安全性等14。
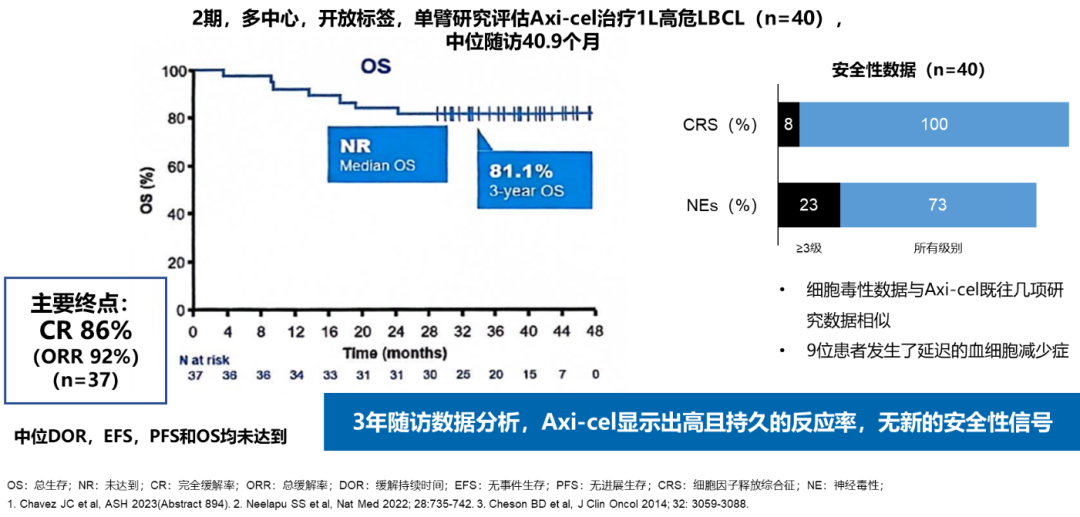
研究结果显示,随访3年Axi-cel的CR达到86%,ORR为92%,3年OS率为81.1%,中位DOR、EFS、PFS和OS均未达到,表明Axi-cel高且持久的缓解率。在安全性方面,细胞毒性数据与Axi-cel既往研究相似,无新的安全性信号14。这项2期研究的积极结果,为进行更大规模的3期研究提供了基础。
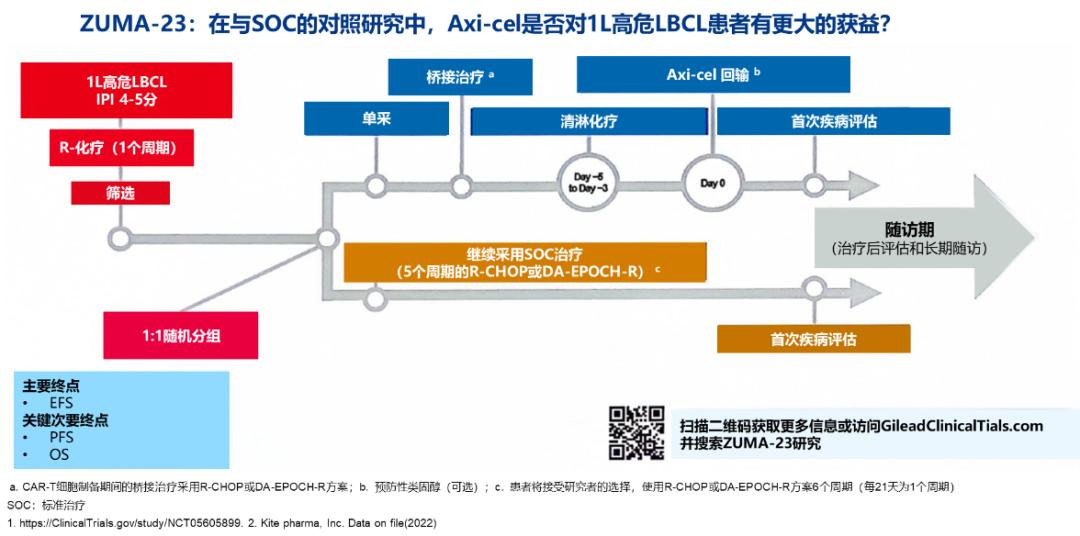
3. ZUMA-23:在与SOC的对照研究中,Axi-cel是否对1 L高危LBCL患者有更大的获益?
ZUMA-23 是首个评估CAR-T疗法 vs. SOC作为高危LBCL患者1L治疗方案的3期随机对照研究。试验将招募 ≈300 例高危、经组织学证实的 LBCL 的成人患者,包括DLBCL、HGBL和转化的滤泡性或边缘区淋巴瘤。符合条件的患者将接受1个周期的R-化疗,然后以1:1的比例随机接受 Axi-cel 或继续接受 SOC。Axi-cel 组的患者将接受白细胞分离术,然后接受 R-CHOP 或 DA-EPOCH-R 作为桥接疗法,然后进行淋巴细胞清除化疗(氟达拉滨/环磷酰胺)和单次Axi-cel输注(2×106 CAR T细胞/kg)。SOC组患者将接受5个周期的R-CHOP或DA-EPOCH-R(研究者选择)。主要终点是盲法中央审查的无事件生存期(EFS)。关键的次要终点是OS和PFS15。
四
微小残留病变(MRD)在1L LBCL临床治疗决策中的作用探索
1.MRD有临床价值吗?
微小残留病变(MRD)在临床治疗决策中具有重要作用,MRD阴性的完全缓解(CR)率已被确认为前线治疗和复发情况下的重要预后指标。FDA抗肿瘤药物咨询委员会一致支持将MRD检测作为骨髓瘤临床试验的早期终点16。

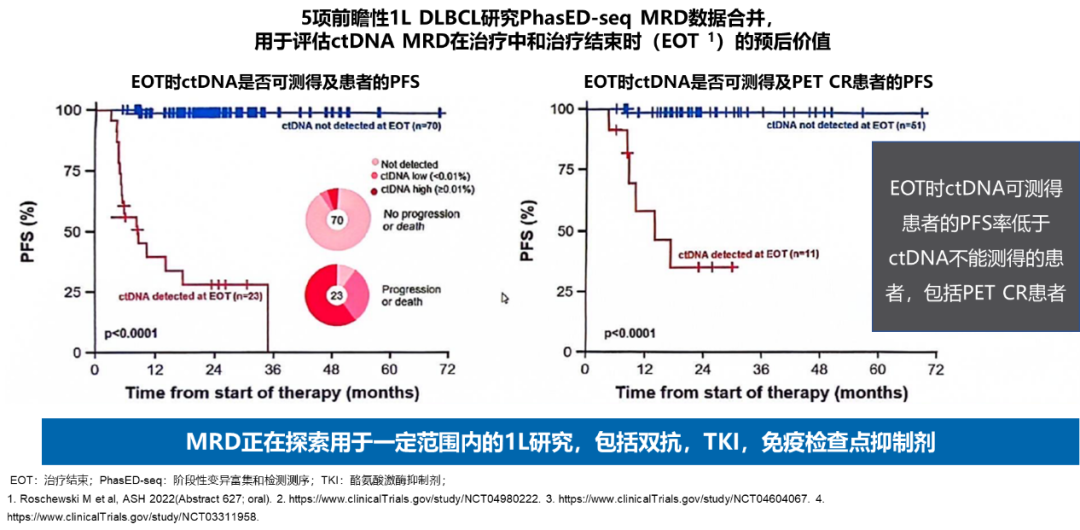
2.在LBCl的1L治疗中,MRD对于PFS有预测价值吗?
在LBCL的1L治疗中,MRD对于预测无进展生存期(PFS)具有潜在价值。通过5项前瞻性1L DLBCL研究的PhasED-seq MRD数据分析,评估ctDNA MRD在治疗中和治疗结束时(EOT)的预后价值。结果表明,在EOT时ctDNA可测得的患者PFS率低于ctDNA不可测得的患者,即使是PET CR患者也是如此17。这强调了MRD检测在评估治疗效果和指导治疗策略中的重要性。
五
总结
大约65%的DLBCL患者在1L治愈。对于IPI评分4-5分的患者,以及伴有双打击或三打击HGBL的患者,1L的预后较差,表明这部分患者对治疗的需求最迫切。尽管有尝试通过改良R-CHOP方案来优化治疗结局,但大多未能成功。CAR-T疗法已展现出改变DLBCL一线治疗格局的潜力。ZUMA-12研究的3年随访数据显示,Axi-cel能够为患者带来高且持久的缓解,且无新的安全信号,这表明CAR-T治疗可能满足一线高危患者的需求并带来获益。

参考文献

