CAR-T细胞治疗淋巴瘤的预后生物标志物探索
嵌合抗原受体T(CAR-T)细胞疗法是一种通过基因工程技术把CAR结构修饰于患者自身T细胞,然后回输至患者体内,以实现抗肿瘤效应的免疫治疗手段,目前在血液学肿瘤领域获得了巨大成功[1,2]。为了准确评估并提高CAR-T细胞治疗的疗效,预测其有效性至关重要。生物标志物是可测量的特征,能够作为正常生物过程、病理过程或治疗反应的指标[3]。目前,越来越多生物标志物被发现,并在预测CAR-T细胞治疗淋巴瘤的疗效中发挥重要作用。本文旨在从肿瘤相关生物标志物和CAR-T细胞产品组成及特征概述当前用于预测CAR-T细胞治疗效果的生物标志物(表1),以期为临床发展提供参考。
1. 肿瘤相关生物标志物用于预测CAR-T细胞疗效
1.1 肿瘤负荷
肿瘤负荷通常指患者体内肿瘤细胞的数量、肿瘤的大小和肿瘤病灶的数量。高肿瘤负荷与低持续缓解率和≥3级神经系统事件(NE)高发生率相关[4]。与肿瘤负荷相关的生物标志物可用于预测患者疗效,包括乳酸脱氢酶(LDH)、循环肿瘤DNA(ctDNA)和循环肿瘤细胞(CTC)[5]。
(1)LDH:血清LDH水平与肿瘤负荷呈正相关[5],LDH水平升高主要由于肿瘤糖酵解活性增加和肿瘤缺氧坏死引起,发挥抑制免疫微环境的作用[6]。一项纳入300例接受CAR-T细胞治疗的复发/难治性大B细胞淋巴瘤(R/R LBCL)患者研究表明,清淋前高水平LDH与较短的无进展生存期(PFS)和总生存期(OS)显著相关,提示LDH可以用于预测CAR-T细胞治疗R/R LBCL患者的生存期[7]。
(2)ctDNA:ctDNA从细胞凋亡和/或坏死的肿瘤细胞中释放,是淋巴瘤的一种新兴生物标志物。一项回顾性分析研究,共纳入48例接受CAR-T细胞治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者的治疗前血清样本,检测了187个淋巴瘤相关基因集的ctDNA。结果显示,治疗前ctDNA突变基因数目≤10个的患者与>10个的患者相比,1年OS率(73.8% vs 0%,P<0.001)和1年PFS率(51.8% vs 0%,P=0.011)更高,提示ctDNA在CAR-T细胞治疗R/R DLBCL患者中可作为预后生物标志物[8]。
(3)CTC:CTC从原发性或继发性肿瘤中脱落并进入人体循环系统。研究表明,CTC数量与肿瘤负荷直接相关,证实CTC是患者生存的可靠预后生物标志物[5]。
1.2 肿瘤相关抗原
肿瘤相关抗原(包括CD19[9]和CD58[3]等)的数量对CAR-T细胞的疗效以及预后具有重要作用。
(1)CD19:肿瘤抗原的丢失或突变可显著影响CAR-T细胞治疗的疗效和患者的整体预后。靶抗原缺失是一种明确的耐药机制,B细胞淋巴瘤通过CD19外显子剪接或基因突变的方式,导致CD19表达缺失或改变,使得肿瘤细胞无法被CD19 CAR-T细胞识别,从而逃避肿瘤杀伤效应[9]。
(2)CD58:淋巴瘤细胞上CD58的存在对于其与CAR-T细胞上CD2的有效黏附和相互作用至关重要,因此CAR-T细胞回输前肿瘤细胞中CD58的缺失会导致疗效不佳[3]。
1.3 炎症状况
基线较高的炎症状态与临床应答较差和严重不良反应有关,与炎症状态相关的蛋白和细胞因子可用于患者预后[10],以便在CAR-T细胞治疗期间给予适当的治疗,最大程度降低不良反应的风险。
(1)C反应蛋白(CRP)和铁蛋白:CRP是一种由肝脏合成的血清蛋白,在机体受到感染或组织损伤时浓度会增加,尤其是在白细胞介素-6(IL-6)升高之后;铁蛋白是一种铁结合蛋白[11]。一项研究共纳入136例接受CAR-T细胞治疗的R/R DLBCL患者,根据基线CRP和铁蛋白将患者分为低危、中危和高危组,结果显示,高危组患者更有可能发生≥3级细胞因子释放综合征(CRS,P=0.001)和≥3级免疫效应细胞相关神经毒性综合征(ICANS,P=0.002),且OS率(P<0.001)和PFS率(P<0.001)较差[10]。
(2)细胞因子:基线高水平IL-6与严重CRS相关[5]。基线IL-15水平与CAR-T细胞峰值数量和疾病缓解率呈正相关[5]。有研究表明,CAR-T细胞回输前高水平的IL-12、树突状细胞溶酶体相关膜蛋白(DC-LAMP)、肿瘤坏死因子相关凋亡诱导配体(TRAIL)和Fas配体的患者OS更长,而CAR-T细胞回输后,高水平的可溶性程序性细胞死亡配体1(sPD-L1)、sPD-L2、IL-6、IL-8和中性粒细胞活化蛋白3(NAP3)患者OS更短[12]。
2.CAR-T细胞产品组成及特征用于预测CAR-T细胞疗效
CAR-T细胞产品组成及特征包括CD4+/CD8+T细胞比值、初始T细胞、耗竭表型的T细胞、其他T细胞亚型、CAR-T细胞扩增和持久性等,均影响CAR-T细胞的疗效[3]。
2.1 CD4+/CD8+T细胞比值
CD4+T细胞和CD8+T细胞在免疫应答过程中扮演重要角色。CD4+T细胞通过分泌细胞因子激活吞噬细胞,增强其清除细胞内病原体的能力,CD8+T细胞则可直接杀伤肿瘤细胞或病毒感染的细胞[13]。CD19 CAR-T细胞中的CD4+/CD8+ T细胞比值是疗效的预后因素。一项事后分析研究显示,3个月时达到缓解患者与未缓解患者相比,回输产品中的CD4+/CD8+T细胞比值较低(比值:0.74 vs 2.47,P=0.011),随访1年时,CD4+/CD8+T细胞比值低于1.12的患者与比值高于1.12的患者相比,中位PFS延长(未达到 vs 76天,P=0.047)[14]。多项研究证明CD4+/CD8+T细胞比值为1的CAR-T细胞疗效更好[3]。
2.2 初始T细胞
CAR-T细胞产品中初始T细胞数量与缓解率和无事件生存期(EFS)呈正相关[4,15],可以用于CAR-T细胞疗效的预后。
2.3 耗竭表型的T细胞
T细胞耗竭是一种T细胞功能障碍的状态。研究表明耗竭表型T细胞(表达CD3+CD28-CD27-)比例高的患者对CAR-T细胞治疗的反应效果不佳[3]。在另一项研究中,CAR-T细胞治疗后无缓解患者的CAR-T细胞产物中,耗竭表型CD8+T细胞(表达CD57+CD39+CD28-)的比例很高[3]。
2.4 其他T细胞亚型
治疗前患者体内高水平辅助性T细胞与完全缓解率高相关[16]。在CAR-T细胞回输前后,高水平Treg细胞的患者,OS显著缩短,且Treg数量与CAR-T细胞持续时间呈负相关[5]。同样,CAR-T中Treg细胞的比例越低,患者获得缓解的效果越好[3]。
2.5 CAR-T细胞扩增和持久性
CAR-T细胞扩增和持久性已被证明是疗效的重要预测指标。研究表明较高的CAR-T细胞扩增峰值和持续高水平存在均与较高的客观缓解相关[3]。
表1 预测CAR-T细胞疗效的生物标志物汇总
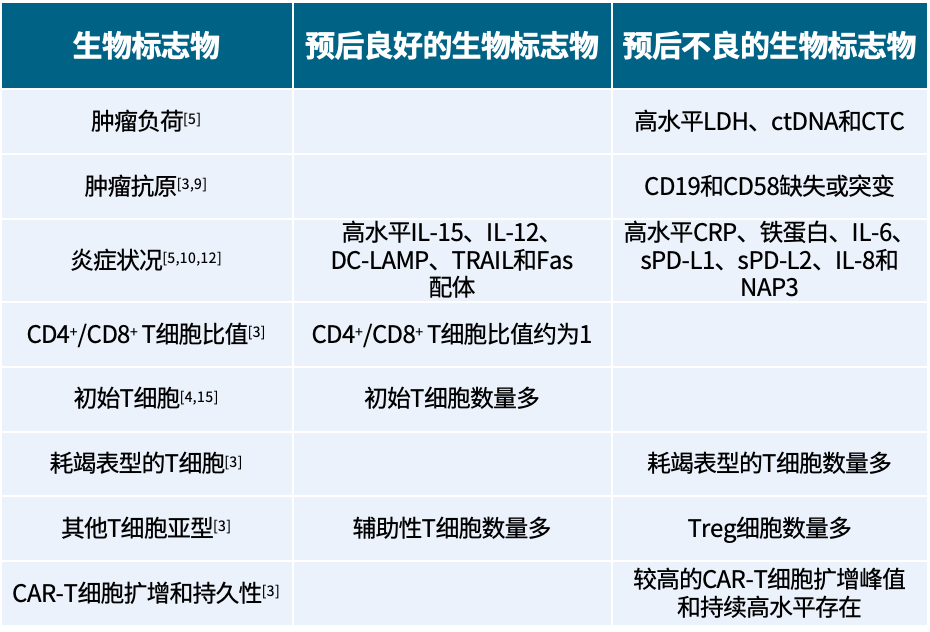
LDH:乳酸脱氢酶;ctDNA:循环肿瘤DNA;CTC:循环肿瘤细胞;CD:白细胞分化抗原;IL:白细胞介素;DC-LAMP:树突状细胞溶酶体相关膜蛋白;TRAIL:肿瘤坏死因子相关凋亡诱导配体;CRP:C反应蛋白;sPD-L:可溶性程序性细胞死亡配体;NAP3:中性粒细胞活化蛋白3;Treg细胞:调节性T细胞。
结 论
综上所述,开发可靠的生物标志物以预测CAR-T细胞治疗的疗效,对临床实践具有多方面的影响。识别可能对CAR-T细胞治疗有反应的患者,有助于将资源集中于最有可能从中受益的患者,并为其他患者提供替代治疗方案的选择。未来研究将进一步优化现有生物标志物,并探索发现新的、更有效的疗效生物标志物,以提高治疗的精准性和效果。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2024.12-6 valid until 2026.12
供稿与审核:临床开发与医学部

