CAR-T细胞疗法:长期随访策略探索
嵌合抗原受体T(CAR-T)细胞疗法是一种通过基因工程技术把CAR结构修饰于患者自身T细胞,然后回输至患者体内,以实现抗肿瘤效应的免疫治疗手段,目前在血液学肿瘤领域获得了巨大成功[1,2]。CAR-T细胞全程管理涉及多个环节,其中长期随访对监测CAR-T细胞的疗效与安全性尤为重要。本文对CAR-T细胞回输后长期随访的目的、随访频率和内容、相关不良事件(AE)以及复发治疗策略进行展开,以期为临床提供参考。
1. CAR-T细胞治疗后长期随访的目的
CAR-T细胞治疗后长期随访的主要目的是收集患者的迟发性AE,了解CAR-T细胞在体内的存续情况、观察疗效随时间的变化情况,从而识别并降低接受CAR-T细胞治疗患者的长期风险,有助于评估CAR-T细胞的获益风险情况[3]。
2. CAR-T细胞治疗后长期随访频率和内容
淋巴瘤患者的长期随访通常从回输后100天开始。对于可治愈的疾病类型(如弥漫性大B细胞淋巴瘤、霍奇金淋巴瘤),治疗结束后的前2年,每3个月随访1次,以后每6个月随访1次至5年,此后每年随访1次。对于不可治愈的疾病类型(如滤泡淋巴瘤、套细胞淋巴瘤),建议每3-6个月随访1次[2]。具体随访检查指标见表1[4]。
表1 CAR-T细胞治疗后长期随访的推荐检查指标
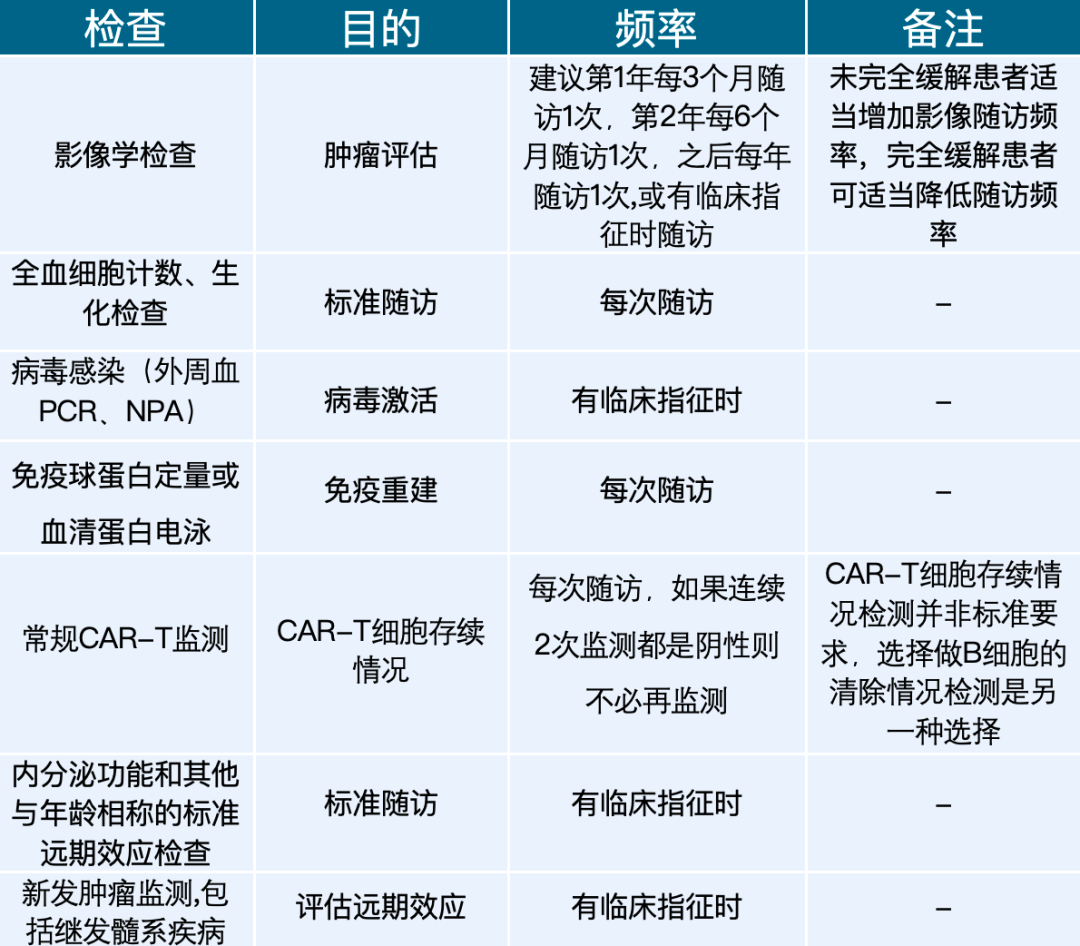
注释:PCR:聚合酶链反应;NPA:鼻咽抽吸物;CAR-T细胞:嵌合抗原受体T细胞。
3. CAR-T细胞治疗后长期随访中常见AE
在CAR-T细胞治疗后长期随访中,仍有部分患者可能发生AE。目前常见的长期AE包括B细胞缺乏症/低丙种球蛋白血症、血细胞减少症、感染和乙型肝炎病毒(HBV)激活[5]。
在接受CD19 CAR-T细胞治疗的B细胞淋巴瘤患者中,长期B细胞缺乏症/低丙种球蛋白血症的发生率较高。长期随访数据显示,在CAR-T细胞回输后数年内,仍有25%-38%的患者发生持续性B细胞缺乏。B细胞缺乏可持续数年,即使在无法检测到CAR-T细胞的情况下也是如此。免疫球蛋白缺乏是B细胞和浆细胞活性受损的结果。长期随访数据表明,18%-74%患者在接受CD19 CAR-T细胞治疗后,持续数年存在低水平的免疫球蛋白G(IgG)[5]。对于CAR-T细胞治疗后患有持续性低丙种球蛋白血症的患者,推荐静脉滴注人免疫球蛋白治疗[6]。
血细胞减少症(包括贫血、血小板减少症和中性粒细胞减少症)为CAR-T细胞治疗相关的常见血液毒性反应。多项研究数据表明,CAR-T细胞回输后,患者可能会发生持续≥3个月的慢性血细胞减少症。在B细胞淋巴瘤患者中,CAR-T细胞回输后≥3个月,3-4级血细胞减少症的发生率约为15%。在一项长期随访研究中,在CD19 CAR-T细胞治疗后达到完全缓解的患者中,有16%发生血细胞减少症,并在细胞回输后持续15-22个月[5]。对于中性粒细胞减少患者,可以给予粒细胞集落刺激因子(G-CSF)治疗。对于贫血患者,推荐回输红细胞或给予红细胞生成素。对于血小板减少患者,可进行血小板回输或给予血小板生成素(TPO)、TPO受体激动剂等治疗[7]。
在CAR-T细胞治疗后长期随访中,感染也有可能发生。与CAR-T细胞回输后第1个月的重度感染发生率相比,CAR-T细胞治疗后>1个月的重度感染发生率相对较低,并且随着时间的推移,其发生率在回输后逐渐降低。在一项长期随访研究中,43例B细胞恶性肿瘤患者接受CD19 CAR-T细胞治疗,中位随访42个月时,9%的患者在CAR-T细胞治疗6个月后因感染需要住院治疗[5]。感染患者建议接受抗感染治疗[6]。
直接针对B细胞的药物可导致HBV再激活,严重时可导致爆发性肝炎、肝衰竭,甚至死亡。乙型肝炎表面抗原(HBsAg)血清阳性及感染已痊愈、HBsAg血清阴性但乙型肝炎核心抗体阳性和/或表面抗体阳性患者均有发生HBV再激活的可能,再激活的风险取决于病毒复制和宿主免疫反应之间的平衡。因此,在长期随访中,患者应该监测肝功能及HBV-DNA情况[8]。
4. CAR-T细胞治疗后长期随访中需关注疾病复发
目前仍有部分患者在CAR-T细胞治疗缓解后疾病复发[9]。对于接受CD19 CAR-T细胞治疗后复发的B细胞淋巴瘤患者,可以采用二次CD19 CAR-T细胞治疗、其他靶点CAR-T细胞治疗、异基因造血干细胞移植、药物偶联物或双特异性抗体等治疗方案,这些治疗方案或许可以改善复发患者的临床结局[9]。
结 论
接受CAR-T细胞治疗的患者需要进行长期随访,以监测和评估CAR-T的长期疗效和安全性,确保患者发生AE时,能够获得及时和适当的医疗干预。CAR-T细胞疗法的长期随访策略是一个复杂而多维的过程,需要综合考虑个体差异、多学科合作和生物标志物的应用等多个方面。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2024.12-25 valid until 2026.12
供稿与审核:临床开发与医学部

